Par Dr. R. Zerarka, Pr. NS. Fedala
Service d’Endocrinologie et Maladies métaboliques. C.H.U Bab El Oued.
Résumé : La relation entre diabète et COVID-19 est bidirectionnelle. Plusieurs mécanismes expliquant la sévérité de l’infection chez les diabétiques sont incriminés.
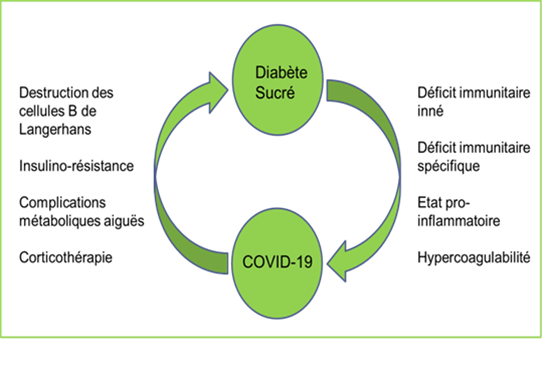
Le mauvais contrôle glycémique favorise la diminution de la défense de l’hôte et de la clairance du virus par dysfonctionnement du système immunitaire. Localement, l’hyperglycémie offre un environnement favorable non seulement à la réplication virale, mais aussi à la surinfection bactérienne. En outre, un état inflammatoire chronique exacerbe la tempête cytokinique qui est à l’origine du Syndrome de détresse respiratoire aiguë. Enfin, une hyper-coagulabilité et une dysfonction endothéliale accentuées chez les diabétiques sont responsables de complications thrombo-emboliques. L’ensemble de ces mécanismes propres au diabète, ainsi que le terrain porteur d’autres comorbidités, rend le diabétique plus susceptible à développer des formes sévères de COVID-19.
Par ailleurs, le SARS-COV2 aurait un effet délétère indépendant sur le métabolisme glucidique en engendrant de nouveaux cas de diabète et en déséquilibrant un diabète préexistant. Nous aborderons à travers cet article le lien physiopathologique reliant ces deux pandémies.
Introduction
Bien que le diabète sucré ne semble pas être un facteur de susceptibilité d’infection au SARS-COV2, les différentes études montrent qu’il est associé à des formes plus sévères.
En effet, la présence d’un diabète a été reconnu comme un facteur indépendant de mauvais pronostic lié aux complications de la COVID-19 : Syndrome de détresse respiratoire aigu (SDRA), nécessité d’admission en unité de soins intensifs (USI), nécessité de recours à une ventilation mécanique et risque majoré de décès.
Le lien physiopathologique entre l’infection au SARS-Cov2 et le diabète est complexe et intriqué.
D’un côté le diabète représente, de façon indépendante, un facteur de risque d’une forme grave de la maladie COVID-19, non seulement de par le déséquilibre glycémique en lui-même et son impact délétère sur le système immunitaire (1,2,3), de par les complications liées au diabète, notamment cardio-vasculaires et rénales, mais aussi de par le terrain sur lequel survient cette maladie qui associe très souvent d’autres comorbidités aussi impliquées dans les formes sévères de la COVID-19 comme l’hypertension artérielle, l’obésité, le syndrome d’apnée du sommeil …etc.
A contrario, l’infection au SARS-CoV-2 déséquilibre drastiquement un diabète préexistant, et semble aussi pouvoir entraîner l’éclosion de nouveaux cas de diabète s’apparentant à des formes de diabète de type 1 (DT1) (4,5).
Effet du diabète sur l’infection au SARS-COV2
L’hyperglycémie chronique et l’insulino-résistance induisent la formation de produits de glycation avancés (AGE) par glycation non enzymatique des protéines. Ces derniers participent au développement d’un stress oxydatif via la production de dérivés réactifs de l’oxygène (ROS) et d’un état pro-inflammatoire (6).Ceci conduit à une altération de la réponse immunitaire aux infections virales et prédispose à une surinfection bactérienne secondaire.
Déficit immunitaire
Immunité innée
Les mécanismes de défense contre les infections virales sont largement médiés par l’immunité innée. Celle-ci est altérée chez les diabétiques (1).
- Neutrophiles : L’hyperglycémie active la protéine kinase C, qui inhibe l’adhésion des neutrophiles à l’endothélium, la migration, le chimiotactisme, et la phagocytose. Par ailleurs, il semble exister chez les diabétiques une sur-expression des TLR qui inhibent la fonction des neutrophiles et leur apoptose (2).
- NK : Il existe une diminution du nombre des deux sous-types de cellules NK (NKG2D+ et NKp46+) chez les diabétiques. L’expression des NKG2D s’est révélée être corrélée négativement avec le niveau de l’HBA1c suggérant qu’une hyperglycémie chronique pourrait influencer directement les défauts des cellules NK par l’action néfaste du stress oxydatif.Il existe aussi des défauts fonctionnels des NK par diminution de la capacité de dégranulation, altérant ainsi la libération des enzymes destinées à éliminer les cellules cibles.
- Monocytes/ macrophages: Il y a une diminution du nombre et altération fonctionnelle de ces cellules.
- Le système complément : L’hyperglycémie entraîne une glycation des protéines du complément et une modification de leur structure tridimentionnelle; ainsi une inhibition de la fixation et de l’opsonisation des antigènes.
- Cellule dendritique: Il semble exister chez le diabétique une diminution de la production de l’interferon (IFN)-α altérant le fonctionnement des cellules dendritiques.
Immunité spécifique cellulaire
Chez les diabétiques, plusieurs anomalies semblent altérer l’immunité spécifique (3), parmi elles :
- Une suppression du HLA 1 sur les cellules myéloïdes.
- Un délai d’activation des cellules TH1 retardé.
- Une réaction anormalement élevée de l’hypersensibilité de type retardée.
Spécifique humorale
La glycation des anticorps est corrélée au degré du déséquilibre glycémique. Ce qui engendre leur altération fonctionnelle.
Toutes ces anomalies se traduisent par un bilan biologique altéré avec une leucopénie et une lymphopénie plus accentuées chez le diabétique atteint de la COVID-19 comparativement au sujet non diabétique.
Etat pro-inflammatoire
L’hyperglycémie augmente la perméabilité capillaire lors de la phase initiale de l’inflammation, probablement via l’activation de la proteine kinase C.De plus, le diabète est caractérisé par une production exagérée de cytokines pro-inflammatoires notamment l’IL-1, l’IL-6, le TNF-a, en l’absence d’une immuno-stimulation. Celle-ci est davantage exacerbée lors d’une stimulation telle que l’infection par le Sars-Cov2.
La préexistence de cet état pro-inflammatoire pourrait accentuer la tempête cytokinique, qui semble être à l’origine du SDRA et de la défaillance multi-viscérale dans la maladie COVID-19.Ceci implique des taux plus élevés des paramètres biologiques de l’inflammation (CRP, ferritine, procalcitonine, IL-6) chez le diabétique par rapport au sujet non diabétique. Ces résultats ont été retrouvés dans pratiquement toutes les séries publiées à ce jour comparant l’infection COVID-19 chez les diabétiques et les non-diabétiques. Cela prédispose à une défaillance multi-viscérale, reflétée par des taux plus élevés chez les diabétiques de LDH, gGT et ALAT.
Hyper-coagulabilité
Les formes sévères et le décès par COVID-19 semblent être dus à des embolies/ thromboses pulmonaires.
Au cours du diabète, il existe un déséquilibre dans la balance entre la coagulation et la fibrinolyse, avec augmentation des facteurs de coagulation et inhibition relative du système fibrinolytique. L’insulino-résistance et le DT2 sont également associés à une dysfonction endothéliale, une hyper-activation et une hyper-agrégabilité plaquettaire. Ces anomalies favorisent le développement d’un état d’hypercoagulabilité (7).
En outre, le taux de plasminogène semble être élevé chez les diabétiques. Ce dernier pourrait augmenter la virulence du SARS CoV-2.
L’implication de ces anomalies se traduit biologiquement par un taux de D-dimères plus élevé, un TQ plus allongé et un TP plus bas chez les diabétiques.
Diabète et tissu pulmonaire
In vitro, des études ont démontré que les cellules épithéliales pulmonaires exposées à une hyperglycémie augmentaient significativement la réplication virale (8).
Dans des modèles animaux, des modifications structurales ont été observées au cours du diabète, comme une hyperperméabilité vasculaire, un épithélium alvéolaire collabé et des échanges gazeux altérés. Cet ensemble de changements prédispose aux formes sévères des infections pulmonaires (9).
SARS-CoV2 et Hb glyquée
Une étude récente a montré que l’une des protéines non structurales de Sars-Cov2 semble attaquer la chaîne B1 de l’hémoglobine, induisant une dissociation du fer et de la porphyrine. Ceci pourrait diminuer la capacité de l’hémoglobine à acheminer l’oxygène vers les tissus cibles. L’une des hypothèses émises est que le Sars-Cov2 aurait une plus grande affinité pour l’hémoglobine glyquée que pour l’hémoglobine non glyquée (10). Cependant, malgré une HBA1C à l’admission élevée (7,7%), l’étude CORONADO n’a pas retrouvé de corrélation entre ce paramètre biologique et la sévérité de la COVID-19 chez les patients diabétiques hospitalisés pour COVID-19. A l’inverse, la glycémie à l’admission était plus élevée chez les sujets ayant une forme sévère (11).
Effet du virus SARS-CoV2 sur le métabolisme glucidique
Voies de pénétration du virus dans les cellules cibles
Le virus pénètre dans la cellule cible via un processus complexe. Le CoV est composé de quatre protéines structurales: les protéines spike (S), de membrane (M), de nucléocapside (N) et d’enveloppe (E) (12).
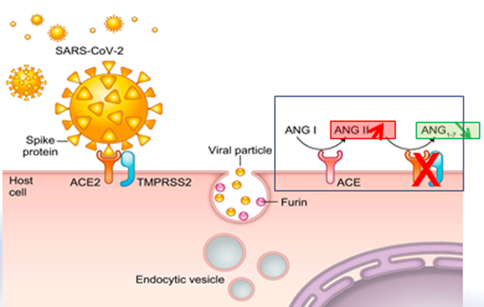
La protéine S reconnaît et se fixe sur le récepteur membranaire de la cellule hôte via le domaine de liaison au récepteur (RBD). L’enzyme de conversion de l’angiotensine 2 (ACE2) est le récepteur cellulaire du SARS-CoV et du SARS-CoV-2. Cette interaction détermine ainsi le tropisme du virus. L’ACE2 est exprimé dans le système respiratoire supérieur, les cellules épithéliales alvéolaires de type I et II dans les poumons, le cœur, les cellules endothéliales, l’épithélium tubulaire rénal, les entérocytes et le pancréas. En temps normal, l’ACE2 convertit l’ANG2 en ANG 1-7.
Après la liaison à ACE2, des sérine protéases telles que TMPRSS2 sont impliquées dans l’amorçage de la protéine S et son clivage. Les protéases telles que la furine libèrent ensuite le peptide de fusion, et le virus pénètre par endocytose. Il est à noter que le taux de furine a été retrouvé plus élevé chez le diabètique. ACE2 est internalisé simultanément que le virus, et son expression subit ainsi une Down-régulation lors d’une infection au Sars-Cov.
La diminution de l’expression de l’ACE2 induit une accumulation de l’ANG2 et une diminution de synthèse de l’ANG1-7
L’ANG 2 exerce un effet vaso-constricteur, pro-oxydant, pro-inflammatoire, pro-fibrotique, et stimule la prolifération cellulaire, essentiellement via les récepteurs AT1.
À l’opposé, l’ANG 1-7 est un vaso-dilatateur, anti-inflammatoire, anti-oxydant, anti-prolifératif, anti-thrombotique via les les récepteurs Mas. (fig1)
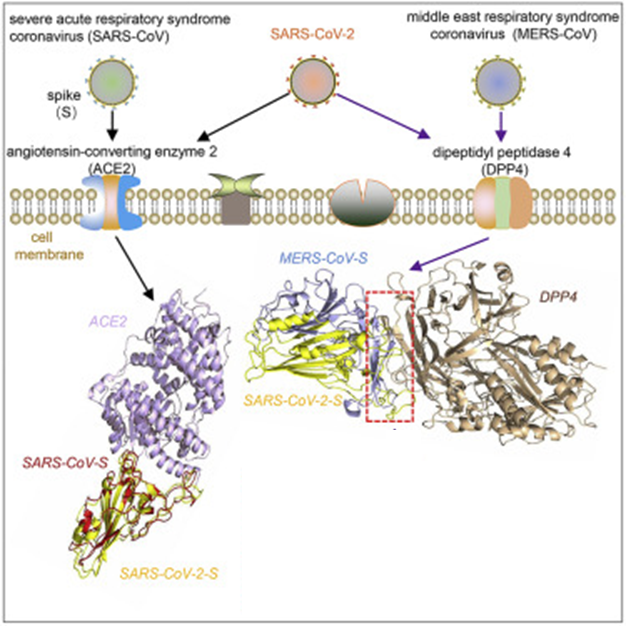
La structure du virus Sars-Cov2 partage une similitude de l’ordre de 80% avec celle du Sars-Cov1, mais aussi de l’ordre de 50% avec celle du Mers-Cov. C’est pourquoi certains auteurs pensent que le SARS-COV 2 pourrait aussi pénétrer dans la cellule de la même manière que le Mers-Cov, c’est-à-dire à travers les récepteurs Dipeptidyl-peptidase 4 (13).Cette théorie reste débattue jusqu’à ce jour.
DPP4, antérieurement connue sous le nom de CD 26, est une protéine membranaire et/ou soluble, appartenant à la famille des sérine protéases, exprimée de façon ubiquitaire (essentiellement Lymphocytes T et les adipocytes) et retrouvée à des taux plus élevés chez les diabétiques et les sujets obèses.( Fig2)
Effet du SARS-Cov2 sur les nouveaux cas de diabète
L’infection par le Sars-Cov2 semble être responsable de nouveaux cas de diabète (14). L’une des hypothèses est que le pancréas et d’autres organes impliqués dans le contrôle de la glycémie sont riches en ACE2. Le virus serait ensuite capable d’entraver la sécrétion d’insuline, voire de détruire les cellules ß-pancréatiques (15).
Une autre possibilité est que le SARS-CoV-2 induise la production de chimiokines et de cytokines responsables d’une réponse immunitaire pouvant également entraîner une destruction cellulaire.
En utilisant un modèle de souris avec un régime riche en graisses, il a été montré que la dé-différenciation des cellules β s’accompagnait d’une réduction de l’ACE2 (16).
La suppression de l’ACE2 a entraîné:
- Une hyperglycémie.
- Une diminution de la teneur en insuline des cellules β.
- Une augmentation du stress oxydatif.
- Une réduction de la masse des cellules β et une altération de leur prolifération.
Le Sars-Cov 2 pourrait donc, à l’instar du Sars-Cov, induire un diabète dont le mécanisme (cytolyse directe des cellules β) s’apparenterait à celui du DT1 insulino-dépendant, néanmoins sans pathologie auto-immune évidente (4).
D’une manière générale, environ 95 % des diabétiques de type 1 sont soit porteurs de l’haplotype DR3 du système HLA, soit HLA-DR4. Les HLA-DQ sont également considérés comme des marqueurs spécifiques de la susceptibilité au diabète de type 1. En revanche, certains haplotypes (par exemple, HLA-DR2) confèrent une forte protection contre le diabète de type 1 (17). Cette susceptibilité génétique se confirme-t-elle dans le contexte de la COVID-19 ? En d’autres termes, les nouveaux cas de diabète apparentés au DT1 causés par le SARS-CoV2 surviennent-ils sur un terrain génétiquement prédisposé ? Malheureusement, il n’existe pas encore de données pouvant répondre à ces interrogations. Cependant, une étude Japonaise (18) a rapporté le cas d’un diabète induit par une vaccination anti-COVID-19, la patiente était porteuse de l’haplotype HLA DRB1*0405-DQB1*0401, sans pour autant pouvoir conclure à un lien de causalité entre le diabète, la COVID-19, et le vaccin. Plus d’études recherchant une prédisposition génétique seraient nécessaires.
Quoi qu’il en soit, plusieurs études suggèrent que ces diabètes de novo semblent associés à un moins bon pronostic de l’infection par le SARS-CoV-2, avec un taux plus élevé de complications et de décès, par comparaison avec les patients normo-glycémiques, mais également ayant un diabète préexistant (5).
Effet du SARS-CoV2 sur le diabète préexistant
L’infection au Sars-Cov2 chez les diabétiques engendre un stress métabolique important avec augmentation des hormones de contre-régulation (Glucocorticoïdes et catécholamines) et augmentation de l’insulino-résistance, par hyper-production d’IL-6, TNF-a, MCP-1, fétuine A. Ceci induit un déséquilibre glycémique majeur, pouvant conduire à des complications métaboliques aiguës (acido-cétose diabétique, état hyper-osmolaire).
L’insuline, en plus de son effet hypoglycémiant, inhibe la synthèse des facteurs pro-inflammatoires, dont l’IL-6 et le TNF-α (18). De surcroît, des études sur des modèles de souris suggèrent que la gestion de l’hyperglycémie restaure l’expression de l’ACE2 et ainsi l’équilibre du système rénine-angiotensine (19). Par conséquent, on pourrait émettre l’hypothèse que l’insulinothérapie pourrait protéger contre les lésions pulmonaires induites par le SRAS-CoV-2 en restaurant l’expression de l’ACE2 et en diminuant la synthèse de l’angiotensine 2.
Par ailleurs, une étude à Wuhan a rapporté que 10% des diabétiques hospitalisés pour COVID-19 ont présenté une hypoglycémie. Celle-ci est associée à une recrudescence de la mortalité cardio-vasculaire (18).
La survenue d’hypokaliémie, par down-regulation de l’ACE2 au cours de l’infection par Sars-Cov2, et ainsi augmentation de la sécrétion d’aldostérone, est aussi impliquée dans le mauvais contrôle glycémique.
Médicaments de l’infection et diabète
Les médicaments utilisés au cours de l’infection interagissent aussi avec le métabolisme glucidique (19), citons par exemple ceux disponibles en Algérie :
- Les corticostéroïdes, comme nous le savons tous, engendrent une hyperglycémie, volontiers post-prandiale, volontiers compliquée d’acido-cétose ou d’état hyper-osmolaire, et ceci en accentuant l’insulino-résistance, en augmentant la néoglucogénèse, en s’interférant avec les GLP-1, et en stimulant la sécrétion de glucagon.
- L’hydroxychloroquine, quant à elle, semble avoir l’effet inverse et induit plutôt des hypoglycémies, une surveillance voire diminution des besoins insuliniques doivent ainsi être de mises.
- L’azithromycine semble aussi déséquilibrer le diabète.
- Le zinc, largement préscrit au cours de cette pandémie, joue un rôle important dans le métabolisme glucidique, il est impliqué dans la cristallisation et la sécrétion de l’insuline au niveau des cellules B. Il régule aussi la translocation des transporteurs de glucose GLUT4. Plusieurs études randomisées ont étudié l’effet d’une supplémentation en zinc sur le contrôle glycémique. Une méta-analyse publiée en 2019 a conclu que la supplémentation en Zinc semble améliorer l’équilibre glycémique avec réduction significative de la GAJ, la GPP, l’HBA1C et augmentation de l’insulino-sensibilité (20).
- Enfin, le confinement et les mesures de restriction prises au cours de la pandémie, diminueraient l’exposition au soleil ayant comme conséquence un déficit en vitamine D. L’hypovitaminose D représente un facteur de risque d’insulino-résistance, et la supplémentation en vitamine D améliore l’insulino-sensibilité (21).
La figure 3 récapitule les différents mécanismes physiopathologiques expliquant la relation bidirectionnelle entre le diabète sucré et la COVID-19.
Diabète en post-COVID
Plusieurs études rétrospectives ont évalué l’incidence du diabète en post-COVID. Rathmann et al ont comparé une cohorte de 35 865 patients ayant développé une infection au SARS-CoV2 documentée, avec un groupe témoin de 35 865 patients ayant eu une autre infection aiguë virale des voies respiratoires, dans une étude rétrospective Allemande multicentrique (22). Ils concluent qu’un diabète nouvellement diagnostiqué a une incidence plus élevée après guérison d’une infection au SARS-CoV2, comparativement à une autre infection virale (15,8 contre 12,3 pour 1000 personne-année) (20). Une étude Britannique confirme ces résultats. L’incidence d’un diabète de novo chez 47 780 patients ayant contracté la COVID-19 a atteint 29 pour 1000 personne-année comparativement à un groupe témoin de la population général (23). Dans une étude Américaine, le Hazard Ratio d’un diabète de novo était de 2,47 dans les 6 mois suivant une infection COVID-19 chez 266 586 patients (24).
Tous ces travaux suggèrent la nécessité d’une surveillance active dépistant un trouble de la régulation glucidique après guérison d’une COVID-19. Mais il n’existe à ce jour aucune recommandation particulière quant aux modalités et au rythme de surveillance de ces patients.
D’autres études doivent être envisagées car plusieurs questions restent sans réponses, notamment la réversibilité de ce diabète post-COVID, l’intérêt du maintien d’une éventuelle insulinothérapie, la pertinence du dosage du peptide C et des anticorps anti-ilôts pancréatiques chez les patients n’ayant aucun facteur de risque de diabète, comme le préconisent Rathmann et ses collaborateurs (22). En attendant, la prise en charge de ces patients doit être individualisée.
Conclusion
L’interaction entre le diabète et l’infection COVID-19 est profonde et complexe . Elle rend le sujet diabétique à haut risque de développer une forme sévère de la maladie. L’infection est propice au déséquilibre glycémique et aux différentes complications métaboliques aiguës du diabète et à l’origine d’une augmentation de la prévalence du diabète sucré insulinodépendant .Une attention particulière doit être entreprise lors de la surveillance de tout diabétique atteint de COVID-19 en particulier.
Bibliographie :
1. The Effect of Short-Term Hyperglycemia on the Innate Immune System amjmedsciVOLUME 351, ISSUE 2, P201-211, FEBRUARY 01, 2016
2. Diabetes causes marked changes in function and metabolism of rat neutrophils in Journal of EndocrinologyAuthors: T C Alba-Loureiro, S M Hirabara. J Endocrinol 2006 Feb;188(2):295-303
3.Knapp S. Diabetes and infection: is there alink? Gerontology 2013 ; 59 : 99-104
4. Autoantibody-negativeinsulin-dependentdiabetesmellitusafter SARS-CoV-2 infection: a case report Nature Metabolism volume 2, pages1021–1024(2020)
5. Relation entre diabète de type 2 et la COVID -19 : les dernières données Sultan A, Halimi S. Med Mal Metab 2021
6. Diabète sucré, stress oxydant et produits de glycation avancée. D. Bonnefont-Rousselot, J.-L. Beaudeux, P. Thérond, J. Peynet, A. Legrand,J. Delattre. Ann Pharm Fr 2004, 62 : 147-157
7.Dunn EJ, Grant PJ. Type 2 diabetes: an atherothrombotic syndrome. CurrMol Med 2005;5(3):323–32. Epub 2005/05/17
8. KohioHinissan P, Adamson Amy L. Glycolytic control of vacuolar-type ATPase activity: a mechanism to regulate influenza viral infection. Virology 2013;444(1-2):301–9.
9. Popov D, Simionescu M. Alterations of lung structure in experimental diabetes, and diabetes associated with hyperlipidaemia in hamsters. EurRespir J 1997;10(8):1850–8.
10. Wenzhong L, HualanL. COVID-19: attacks the 1-beta chain of hemoglobin and captures the porphyrin to inhibit human heme metabolism.10.26434/chemrxiv.11938173.v9
11. Bertrand Cariou, Pierre Gourdy, Samy Hadjadj, Matthieu Pichelin, Matthieu Wargny. Diabète et COVID-19 : les leçons de CORONADO. Med Mal Metab 2021; 15: 15–23.
12. COVID-19 pandemic, coronaviruses, and diabetes mellitus. RanganathMuniyappa and SriramGubbi.Am J PhysiolEndocrinolMetab 318: E736–E741, 2020.
13. DPP4 and ACE2 in Diabetes and COVID-19: Therapeutic Targets for Cardiovascular Complications? Front. Pharmacol., 07 August 2020
14. Diabetic ketoacidosis precipitated by Covid-19 in a patient with newly diagnosed diabetes mellitus Diabetes Research and Clinical Practice Volume 164, June 2020, 108166
15. YangJin-Kui,LinShan-Shan, JiXiu-Juan,GuoLi-Min.BindingofSARScoronavirustoitsreceptordamagesisletsandcauses acute diabetes. ActaDiabetol 2010;47(3):193–9.
16. Xuan, X. et al. Activation of ACE2/angiotensin (1-7) attenuates pancreatic β cell dedifferentiation in a high-fat-diet mouse model. Metabolism 81, 83–96 (2018).
17. Salem ESB, Grobe N, Elased KM. Insulin treatment attenuates renal ADAM17 and ACE2 shedding in diabetic Akita mice. Am J Physiol Renal Physiol 306: F629–F639, 2014. doi: 10.1152/ajprenal.00516.2013
16. COVID-19 and diabetes: Knowledge in progress. Akhtar Hussain, BishwajitBhowmik ,Nayla Cristina do Vale Moreira Diabetes research and clinical practice162(2020)108142
17-Janelle A Noble, Ana M Valdes.Genetics of the HLA region in the prediction of type 1 diabetes. Current Diabetes Reports 2011, 11 (6): 533-42
18 – Kanako Sakurai,Daiki Narita,Naomi Saito,Takayuki Ueno,Ryota Sato,Satsuki Niitsuma,Kazuhiro Takahashi,Zenei Arihara Type 1 diabetes mellitus following COVID-19 RNA-based vaccine journal of diabetes investigations Volume13, Issue7 July 2022 Pages 1290-1292
19. COVID-19 and diabetes mellitus: Anunholy interaction of two pandemics RimeshPal , Sanjay K. Bhadada. Diabetes MetabSyndr. 2020 July-August; 14(4): 513–517
20. Zinc supplementation improves glycemic control for diabetes prevention and management: a systematic review and meta-analysis of randomized controlled trials; Wang and al. The American Journal of Clinical Nutrition, Volume 110, Issue 1, July 2019
21. Analysis of Association between Vitamin D Deficiency and Insulin Resistance; Nutrients 2019, 11(4), 794
22. Wolfgang Rathmann & Oliver Kuss & Karel Kostev4 Incidence of newly diagnosed diabetes after Covid-19. Diabetologia (2022) 65:949–954
23. Ayoubkhani D, Khunti K, Nafilyan V et al (2021) Post-Covid syndrome in individuals admitted to hospital with covid-19: retrospective cohort study. BMJ 372:n693.
24. Daugherty SE, Guo Y, Heath K et al (2021) Risk of clinical sequelae after the acute phase of SARS-CoV-2 infection: retrospective cohort study. BMJ 373:n1098.