A. Otmane, S. Acid, F. Allane, M. Makrelouf, A. Zenati
Laboratoire de recherche de Biochimie génétique, Faculté de Médecine Alger 1/ CHU de Bab El Oued
L’insulino-résistance est considérée comme une étape cruciale dans la physiopathologie du DT2, ce qui rend son évaluation importante auprès des patients diabétiques type2. Cette étude vise à déterminer la prévalence de l’insulino-résistance par l’indice de HOMA, QUICKI, TyG, et le ratio TG/HDLc, et de comparer entre ses formules d’estimation de l’insulino-résistance.
Matériel et méthodes
Nous avons mené une étude observationnelle descriptive auprès de 205 diabétiques de type 2 âgés entre 30 et 70ans, non insulinodépendants, non hypertendus, sans insuffisances rénale. Ces patients ont été évalués à l’aide d’un questionnaire, et un bilan biologique à jeun a été effectué. Les paramètres étudiés sont : l’activité physique, les paramètres anthropométriques, le bilan lipidique, glucidique, l’insulinémie à jeun, et l’estimation de l’insulinorésistance selon les indices HOMA, QUICKI , TyG et le ratio TG /HDLc.
Résultats et discussion
La prévalence de l’insulinorésistance était 56.10% selon l’indice HOMA, 20% selon l’indice QUICKI et 70.24% selon l’indice TyG. La prévalence du syndrome métabolique était de 56.59% avec une prédominance féminine (66,3%). L’indice HOMA par rapport aux autres index comme TyG et QUICKI a démontré une association avec le ratio TG/HDLc (p>0.05), alors qu’on a trouvé une différence significative d’une part entre ces 3 indices en comparant 2 à 2, et d’autre part entre le ratio TG/HDLc et QUICKI , ainsi qu’ entre le ratio TG/HDLc et TyG (p<0.05).
La comparaison des indices en fonction du sexe a révélé qu’il n y’avait pas de différence significative ( p>0.05). Nous avons observé une parfaite corrélation négative, et significative entre l’indice HOMA et QUICKI(r = −1.000, p < 0.05) ainsi que positive et significative entre l’indice TyG et le ratio TG/HDLc (r= 0.833, p < 0.05). Nous avons également noté que l’indice HOMA et QUICKI se corrèlent de la même force et signification avec l’indice TyG et le ratio TG/HDLc.
Conclusion : Des différences de prévalences de l’insulino-résistance selon les 3 indices, ont été constatées. Ces indices sont associés au syndrome métabolique, particulièrement l’indice TyG et le ratio TG/HDLc, et l’hyper-insulinémie était mieux apprécié par l’indice HOMA.
Introduction
La résistance des tissus périphériques à l’action de l’insuline ou insulinorésistance, est un facteur incriminé étroitement dans la physiopathologie du syndrome métabolique et de l’obésité au cours du diabète type 2 (DT2) et d’autres pathologies cardiovasculaires. (1)
Plusieurs index pour l’estimation de l’insulinorésistance sont disponibles, le plus utilisé est l’indice de HOMA-IR. Cependant, d’autres mesures directes comme le clamp euglycémique et aussi indirectes sont validées pour apprécier le statut d’insulinorésistance, parmi elles l’indice de QUIKI et récemment l’indice TyG qui inclut le taux des triglycérides circulants. (2,3)
Les objectifs de ce travail sont de déterminer la prévalence du syndrome métabolique selon l’IDF et celle de l’insulinorésistance chez les patients diabétiques de type 2, par l’indice de HOMA, l’indice de QUICKI, l’indice TyG et le ratio TG/HDLc. Et comparer entre ces différentes formules d’estimation de l’insulinorésistance. (4,5)
Matériels et méthodes
Patients
C’est une étude prospective, descriptive et analytique réalisée au niveau du Laboratoire central du CHU de Bab El Oued (hôpital MOHAMED LAMINE DEBAGHINE), 205 patients diabétiques type 2 âgés entre 30-70 ans ont été inclus. Les critères de non inclusions étaient : les diabétiques de type 2 sous insuline, les diabétiques de type 1, le diabète gestationnel, les diabétiques avec insuffisance rénale, et l’hypertension artérielle essentielle ayant survenue avant le DT2.
Les patients ont signé un consentement éclairé avant d’être inclus dans l’étude, selon les normes du comité d’éthique nationale.
Paramètres anthropométriques
La récolte des informations des patients a été réalisée à l’aide d’un questionnaire, complété par les mesures anthropométriques (poids, taille, tour de taille), pour calculer l’indice de masse corporelle (IMC) qui est considérée comme indicateur de l’obésité nous avons utilisé la formule de QUETLET : IMC = Poids (kg)/Taille² (m²), le tour de taille (cm) pour estimer une obésité abdominale.
La prise de la tension artérielle a été réalisée au moment du rendu des résultats par un tensiomètre manuel (Star Care) chez des sujets en position assise et au repos pendant au moins 15 minutes.
Paramètres biochimiques
Des prélèvements sanguins veineux (12 heures de jeun) ont été effectués sur 3 tubes : un tube sec, hépariné et EDTA. Les tubes secs et héparinés sont centrifugés à 4000 tours /min pendant au moins 10 min, puis récupération du surnageant (sérum et plasma). Le dosage des différents paramètres biochimiques s’est effectué sur les automates Cobas® 6000, et Cobas®400.
Les patients ont bénéficié d’un bilan biochimique qui comprend le dosage de la glycémie, l’HbA1c, le bilan lipidique complet :cholestérol total, triglycérides, HDLcet calcul du LDLc par la formule de Friedwald, le bilan rénal (urée, créatinine, acide urique), taux de protides et albumine, le bilan hépatique (ASAT, ALAT, GGT) et la CRP ultrasensible.
Une formule de numération sanguine (F.N.S) a été réalisée par l’automate ADVIA (Siemens), et le dosage de l’insuline a été fait sur Immulite 2000 XPI (Siemens). Un contrôle de qualité de l’exactitude est réalisé quotidiennement avec chaque série de mesure pour tous les paramètres, à l’aide de 2 niveaux de sérums de contrôle. Les indices de l’insulinorésistance ont été calculés selon les formules suivantes :
HOMA-IR= Insuline (µUI/ml) x glucose (mmolo/l)/22.5 ; valeur seuil<2.4
QUIKI=1/ (log insuline [µUI/ml]+log glucose[mg/dl]) ; valeur seuil <0.30
Index TyG= Ln (TG [mg/dl)x glucose [mg/dl)]/2; valeur seuil < 8.8
Analyse statistique
La saisie des données a été faite sur Excel, puis transféré sur le logiciel SPSS version IBM SPSS Statistics19.
Les statistiques descriptives des sujets ont été calculées, les données sont présentées sous forme de moyenne ± écarts types, médiane et intervalle de confiance, et sous forme de pourcentage pour les variables qualitatives. La normalité des variables quantitatives a été vérifiée à l’aide d’un test de Kolmogorov-smirnov et Shapiro-Wilk.
Un test de khi 2 a été utilisé pour comparer les proportions.
La comparaison entre les indices d’insulinorésistance a été faite par le test de Wilcoxon-Mann-Whiteney.
Les corrélations entre2 variables quantitatives sont exprimées par le coefficient de corrélation de Rho de Spearman. Une valeur P <0,05 a été considérée comme statistiquement significative.
Résultats
Notre cohorte est composée de 205 patients diabétiques type 2, répartis en 118 femmes et 87 hommes. La moyenne d’âge de la population étudiée est de (55,55± 8,79) ans avec des extrêmes d’âge de 30 ans et 70 ans.
On remarque que la majorité de nos patients soit 43,41%, leur âge se situe dans la tranche [50-59] ans, suivis en deuxièmes place par la tranche d’âge [60-70] ans avec 33,66%.
L’ancienneté moyenne du DT2 est de 5.98±5.42 ans. Dans notre cohorte, on constate que la plupart des patients (53.20%) ont un DT2 récent <5ans suivi par 28.08% patients dont l’ancienneté est entre 6et 10 ans.
La classes thérapeutique la plus prescrite en monothérapie est celle des biguanides avec 67,80% (Glucophage), suivie par les sulfamides avec 1,95%; en bithérapie (1biguanide+1sulfamide) avec 18,54% ; et seulement 2,44% en trithérapie (1biguanide+1 sulfamide+1inhibiteurd’alphaglucosidase) .
L’analyse des questionnaires de nos patients a révélée l’existence d’antécédents familiaux en relation avec le DT2 et/ou d’autres pathologies. On note que 51.22%, ont un ou plusieurs parents atteints du DT2, Suivi par 36.59 % des patients dont les parents sont indemnes de toute pathologie.
On observe que 61.95% de nos patients font une activité physique soit la marche avec (54,15%) ou le sport avec (3.41%), soit les deux avec (4.39%), alors que 38.05% patients sont sédentaires.
Sur le plan métabolique 45,37% des patients sont en surpoids et 35,61% sont obèses. Alors que, près de 18.54% de ces patients DT2 ont un IMC dans les normes, 69.86% de ces malades ont une obésité modérée et 21.92% ont une obésité sévère. L’obésité morbide a été retrouvée chez 8.22% d’entre eux. L’obésité abdominale est plus importante chez les femmes (89.83%) avec une moyenne de TT de (101,15±14,31cm), que chez les hommes (57.47%) qui ont une moyenne de (104,52±9,56 cm).
Pour l’équilibre glycémique, 36.10% des patients recrutés ont un bon équilibre avec une moyenne de HbA1c (6.58±0.27). Alors que 48.29% ont un mauvais contrôle glycémique avec une moyenne de HbA1c de (8.52±1,70 %). (cf Tableau 1)
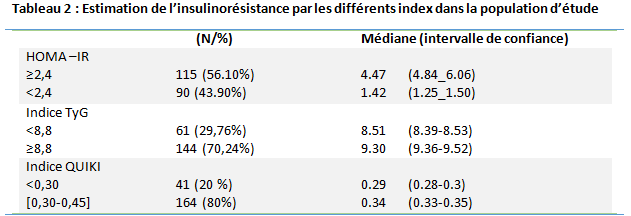
La prévalence du sMet est de 56.59%, on observe que 46.69% des patients ont 3critères, 36.21% ont 4 critères, et 18.10 % parmi eux présentent un sMet avec 5 critères. Selon l’indice HOMA-IR, on constate que la majorité des patients présentent une IR (56.10%), alors que 43.90% sont non IR.
Pour l’indice de QUICKI 80% des patients ont un indice dans les normes c’est-à-dire entre 0.30 et 0.45, donc une bonne insulino-sensibilité, alors que 20% des patients voient leur indice inférieurs à 0.30 ce qui signifie une forte insulino-résistance chez eux, et donc une faible sensibilité à l’insuline.
Quant à l’indice TyG, 70.24% soit 144 patients ont un indice TyG ≥ 8.8 avec une moyenne de (9,44±0.48) et 29.76% soit 61 patients ont un indice TyG< 8.8 avec une moyenne de (8,46±0.26). (cf Tableau 2)
| (N/%) | Moyenne ± Ecart-type (mediane) | |
| Age (ans) [30-39] [40-49] [50-59] [60-70] | 205 12 (5,86%) 35 (17,07%) 89 (43,41%) 69 (33,66%) | 55,55± 8,79 |
| Genre Hommes Femmes | 87 (42.44%) 118 (57.56%) | |
| Ancienneté du DT2 < 1 an [1-5] ans [6-10] ans >10 ans | 13 (6.40%) 108 (53,20%) 57 (28,08%) 25 (12,32%) | |
| Antécédents familiaux Diabète HTA Sans ATCD | 93 (45.36%) 34 (16.59%) 78 (38.05%) | |
| Activité physique Non Oui | 78 (38.05%) 127 (61.95%) | |
| Syndrome métabolique (IDF) Oui Non | 116 (56.59%) 89 (43.41%) | |
| IMC (Kg/m2) <18,5 [18,5-25[ [25-30] > 30 | 1 (0,49%) 38 (18,54%) 93 (45,37%) 73 (35,61%) | 22.71±1.73 27.65±1.22 33.82±3.67 |
| Tour de taille (Cm) Hommes <94 cm ≥94 cm Femmes <80 cm ≥80 cm | 37 (42.53%) 50 (57.47%) 12 (10.17%) 106 (89.83%) | 87 (82.30-87.48) 103 (101.80-107.24) 71 (65.04-74.13) 99.5 (98.40-103.91) |
| Glycémie (g/l) | 1.48 (0.48) g/l | |
| Créatinine (mg/l) | 8.18 (4.50)mg/l | |
| HbA1c (%) [4.8 – 6.0] (%) [6.1 – 7.0] (%) >7(%) | 32 (15.61%) 74 (36.10%) 99 (48.29%) | |
| Cholestérol total (g/l) <1.45 [1,45-2] >2 | 36 (17,56%) 119 (58,05%) 50 (24,39%) | 1.32 (1.196-1.310) 1.71 (1.682-1.734) 2.22 (2.237-2.434) |
| Triglycérides (g/l) [0,5-1,5] >1,5 | 121 (59%) 84 (41%) | 0.94 (0.94-1.03) 2.00 (2.06-2.39) |
| HDLc (g/l) Hommes <0.45 ≥0.45 Femmes <0.50 ≥0.50 | 64(73.56%) 23(26.44%) 74(62.71%) 44(37.29%) | 0.36 (0.33-0.39) 0.53 (0.47-0.81) 0.41 (0.38-0.45) 0.58 (0.58-0.74) |
| LDLc (g/l) | 205 | 1.40 (1.34-1.48) |
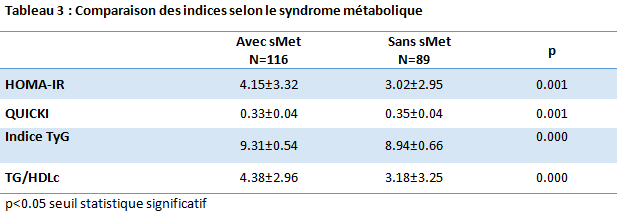
On observe une différence statistique significative entre le groupe des DT2 avec sMet et le groupe des DT2 sans sMet pour tous les indices d’IR TyG (p=0.000), QUICKI (p=0.001), HOMA-IR(p=0.001) et le ratioTG/HDLc (p=0.000).
Le test de Wilcoxon-Mann-Withneya été utilisé pour la comparaison entre chaque couple d’indice. On constate qu’il y a une différence statistique significative entre l’indice HOMA et QUICKI (p=0.000), HOMA et TyG (p=0.000), TyG et TG/HDLc(p=0.000), QUICKI et TG/HDLc (p=0.000), ainsi que QUICKI et TyG (p=0.000). Tandis que l’indice HOMA et le ratio TG/HDLc ne présente pas une différence significative (p=0.433). (cf Tableau 3)
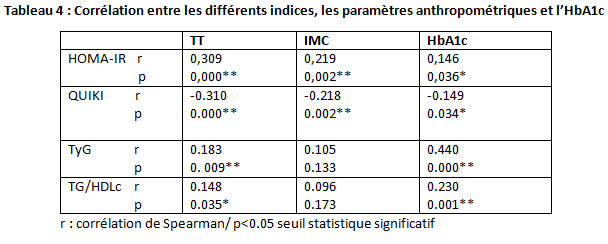
L’indice HOMA-IR est significativement corrélé positivement aux TT, IMC et HbA1c (p=0.000, p=0.002, p=0.036) respectivement. L’indice QUICKI est significativement corrélé aux TT, IMC et HbA1c (p=0.000, p=0.002, p=0.034) respectivement.
L’indice TyG est significativement corrélé aux TT,et HbA1c (p=0.009, p=0.000) respectivement, alors qu’il très faiblement corrélé à l’IMC( p=0.133). Le ratio TG/HDLc est significativement corrélé aux TT,et HbA1c (p=0.035, p=0.001) respectivement, alors qu’il très faiblement corrélé à l’IMC( p=0.173).
On constate une corrélation négative forte et significative entre l’indice HOMA et QUICKI (r= -1.000, p=0.000) ;Egalement, le coefficient de corrélation Rho de Spearman vaut (r=0.833) indique une forte corrélation positive et significative (p=0.000) entre l’indiceTyG et le ratio TG/HDLc. Les coefficients de corrélation de RHO-spearman montrent des corrélations négative forte et significatives entre l’indice QUICKI et HOMA pour les deux population masculine (R=-1.000) et féminine(R=-1.000) , pour les deux groupes avec et sans sMet (RavecSMET=-1.000 ; RsansSMET=-0.999).
Les coefficients de corrélation de RHO-spearman, indiquent des corrélations positives et significatives entre l’indice TyG et HOMA pour les deux population masculine(R=0.290) et féminine(R=0.464) , pour les deux groupes avec et sans sMet (RavecSMET=0.255 ; RsansSMET=0.381. Alors que pour le sous-groupe homme avec sMet la corrélation est très faible et non significative (RH avec SMET=0,019 ; p=0,907). (cf Tableau 4)
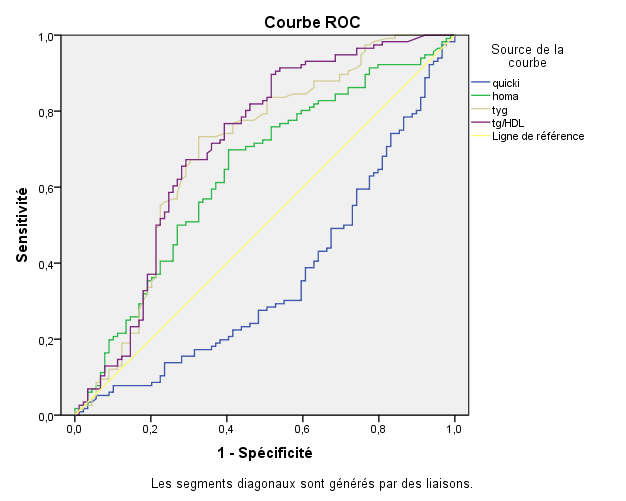
Pour la courbe ROC, la variable d’état utilisée est l’insulinémie >10( µUI/ml), l’AUC de l’indice HOMA est la plus importante (0.968m2 ), suivi de près par celle du ratio TG/HDLc (0.635m2 ) et de l’indice TyG (0.630m2 ) , et en dernière position l’indice QUICKI(0.032m2 ). (cf Figure 1)
Discussion
Dans cette étude on observe une prédominance féminine avec 57.56%, ceci a été retrouvé dans la plupart des études Algériennes sur les maladies chroniques comme celle de Yahia et al 2011(5), MALEK et al 2019 (6), ainsi que dans des études Tunisiennesde TEMSSEK et al 2012 (7), et Abdessalem et al 2018 (8),
L’âge moyen de la population est de 55,55± 8,79 ans, une majoration est observée pour les patients entre [50-59]ans (43,41%), suivis de près par les plus de 60ans (33,66%.), ce résultat est proche de l’étude de NOURI 2014 (9), plusieurs études ont montré que l’âge avancé représente un facteur favorisant l’apparition du diabète AZZOUZ et al 2013 (10) ;
Pour l’ancienneté du DT2 elle est variable avec une moyenne de 5.98±5.42 ans ; cette moyenne est proche de celle trouvés dans l’étude de Abdessalem et al 2018 (8) estimée à 7 ± 3,8 ans. On remarque que 53.20% des malades ont un diabète récent de 1 à 5ans GUIRA et al 2016 (11) .
Pour les antécédents familiaux, 51.22% des patients recrutés avaient un ou plusieurs parents diabétiques (DT2), ce qui implique le facteur héréditaire dans la transmission du DT2 AZZOUZ et al 2013 (10).
Pour l’activité physique, 38.05% des patients sont sédentaires, ceci est moins important par rapport aux résultats retrouvés dans l’étude de OUHDOUCH et al 2009 au Maroc (sédentarité dans 85% des cas) (12), cela indique une prise de conscience de l’importance de l’activité physique. Nous avions noté que 7,8% des patients pratiquent du sport ce qui était proche de l’étude de Marceline et al 2014. (6,7% )(13).
Plus de 2/3 de nos patients ont un IMC ≥ 25(kg/m2), la majorité d’entre eux sont en surpoids (45.37%) ou obèses (35.61% ) ,ce profil répond à celui du diabétique de type 2 comme l’avait constaté l’études (11, 14) et TAHINA INSP 2005 (15).
Pour les TT, l’obésité abdominale touche plus souvent les femmes (89.83%) que les hommes (57.47%), cette observation est similaire à celle de MARCELINE et al 2014(13,16).
Les dyslipidémies étaient présentes chez la plupart de nos patients : 24,39% avaient une hypercholestérolémie, 73.56% des hommes et 62.71% des femmes avaient une hypoHDLémie ; 56.59% ont un taux de LDLc supérieurs à la norme optimal et 40.98% des patients ont un taux de TG > 1.5(g/l). Les anomalies lipidiques habituellement retrouvées chez un diabétique type 2 sont : l’hypertriglycéridémie, l’hypoHDLémie et une anomalie quantitative de LDLc.(9, 16) .
La relation entre le sMet et le diabète type 2 ainsi que sa prédominance féminine a été déjà démontrée dans plusieurs études. En effet ; la fréquence du syndrome métabolique augmente avec le déséquilibre de la glycémie. (7, 11, 17)
La prévalence des patients ayant 3 critères était plus importante (45.69%), puis 36.21%avec 4 critères, ensuite 18.10 % avec 5 critères. La prévalence des patients avec sMet diminue en fonction du nombre de critères ou sévérité du sMet. (17,18)
L’insulinorésistance selon l’indice HOMA (56.1%), selon l’indice QUICKI (20%) et 70.24% selon l’indice TyG , divergent de l’étude de MENIK 2006 (19). Cette différence serait due aux valeurs seuils différents entre les 2 cohortes (2.6 pour HOMA et 0.33 pour QUICKI). Dans l’étude tunisienne de ABDESSELEM et al 2018 (8), l’indice HOMA-IR était élevé chez 30 % des patients.
L’IR selon l’indice HOMA était plus fréquente chez les femmes que les hommes, ceci est comparable à l’étude de CHANG et al (20, 21). Les moyennes des indices sont plus élevées dans le groupe avec sMet, de ce fait ces patients ont une insulinorésistance marquée. Le syndrome métabolique est fortement lié à l’obésité et en particulier à l’obésité abdominale. Le test de Wilcoxon- Mann-Whitney a montré qu’il existe une différence statistique significative entre les 3 indices d’IR (QUIKI, HOMA, et TyG) (p<0.05). Cependant la valeur p de ratio TG/HDLc et l’indice HOMA était supérieur à 0.05. (22,23)
Le nombre de critères de sMet augmente plus l’IR pour l’indice HOMA et pour l’indice TyG (1). La corrélation de l’IMC et l’indice HOMA pour toute la cohorte était faiblement positive et significative de l’ordre de( r=0.219) ceci était similaire aux résultats retrouvés dans l’étude CHANG et al (r= 0.25). Cette corrélation entre l’indice HOMA et QUICKI est négative et significative (r= -1.000) ce qui monte une forte corrélation comme dans l’étude de KATZ et al 2000 ( r= -0.77). On a également noté que cette forte corrélation est négative et significative chez les 4 groupes (avec et sans sMet, population masculine et féminine) et chez les 4 sous-groupes (Femmes avec et sans sMet , Hommes avec et sans sMet). (24)
Le coefficient de corrélation entre l’indice HOMA et TyG était positif et significatif (r=0.384) ; comme l’avait rapporté l’étude de LEE et al 2016 (25). L’analyse de l’AUC des courbes ROC a montré que l’indice TyG et le ratio TG/HDLc sont les meilleures pour la détermination du statut de l’insulinorésistance au cours du sMet. Par ailleurs, l’indice HOMA est le plus performant pour l’évaluation de l’hyperinsulinisme, et l’indice QUICKI est le plus convenable à l’évaluation de l’insulinosensibilité. Le test Khi2 avait montré qu’il existe une association significative entre le nombre de critére du sMet et l’indice TyG, HOMA et QUICKI. La corrélation de l’IMC et l’indice HOMA pour toute la cohorte était faiblement positive et significative de l’ordre de( r=0.219) ceci était similaire aux résultats retrouvés dans l’étude CHANG et al(r= 0.25).
Le coefficient de corrélation est positif significatif entre le TT et HOMA (r=0. 309, p<0.05), cette corrélation est semblable à l’étude abdessalem et al 2018(r=0,412, p<0.001 ). Cette corrélation entre l’indice HOMA et QUICKI est négative et significative (r= -1.000) ce qui monte une forte corrélation comme dans l’étude de KATZ et al 2000 ( r= -0.77)(115). On a également noté que cette forte corrélation est négative et significative chez les 4 groupes (avec et sans sMet, population masculine et féminine) et chez les 4 sous-groupes (Femmes avec et sans sMet , Hommes avec et sans sMet). (26)
Le coefficient de corrélation entre l’indice HOMA et TyG était positif et significatif (r=0.384), cette corrélation devenait plus importante chez les femmes(R=0.464) , et chez les Hommes sans sMet (r=0,385). (27,28)
Conclusion
Le syndrome métabolique est très fréquent chez les diabétiques de type 2 particulièrement chez les femmes avec son critère principal l’obésité abdominale, qui majore le risque cardiovasculaire chez ces patients,
L’insulinorésistance est considérée comme une étape cruciale dans la physiopathologie du DT2, ce qui rend son évaluation importante auprès de ses patients. En effet on a constaté une prévalence décroissante de l’IR selon les indices TyG, HOMA, et QUICKI, avec également une différence statistique significative entre ces indices.
Bien que la technique gold standard reste le clamp euglycémique hyperinsulinique, l’indice HOMA et QUICKI sont parfaitement corrélés ce qui permet de noter qu’une personne IR selon l’indice QUICKI est obligatoirement IR selon l’indice HOMA. Les indices QUICKI et TyG ainsi que HOMA et TyG sont mieux corrélés chez la population féminine. Ces indices d’insulinorésistance sont associés au syndrome métabolique, particulièrement l’indice TyG et le ratio TG/HDLc. Ceci indique l’importance de prendre en charge les patients par une bonne sensibilisation ,et un bon suivi en se référant à des indices simples et fiables comme l’indice TyG et le ratio TG/HDLc.
Bibliographie :
[1] Punthakee Z, Goldenberg R, Katz P. Definition, Classification and Diagnosis of Diabetes, Prediabetes and Metabolic Syndrome. Canadian Journal of Diabetes. avr 2018 ; 42:S10‑5.
[2] Bonora E. Diabetes. epidemiology, genetics, pathogenesis, diagnosis, prevention, and treatment. New York, NY: Springer Berlin Heidelberg; 2018.
[3] Amira Maoui, Kahena Bouzid, Asma Ben Abdelaziz, Ahmed Ben Abdelaziz. Epidemiology of Type 2 Diabetes in the Greater Maghreb. Example of Tunisia. Systematic Review of the Literature – PubMed. Tunis Med. févr 2019; 97(2):286-295.
[4] Tenenbaum M, Bonnefond A, Froguel P, Abderrahmani A. Physiopathologie du diabète. Revue Francophone des Laboratoires ; 2018 ; 502 :26‑32.
[5] Yahia-Berrouiguet, A., Benyoucef, M., Meguenni, K., & Brouri, M. (2011). Enquête sur la prévalence des facteurs de risque de maladies cardiovasculaires à Tlemcen (Algérie). Médecine des maladies Métaboliques, 5(4), 42‑48. https://doi.org/10.1016/S1957-2557(09)74761-3
[6] Malek, R., Osmani, K., Serouti, A., & Abrouk, S. (2019). Résultats de l’International Diabetes Management Practices Study (IDMPS) Vague 7. Algérie. Médecine des Maladies Métaboliques, 13(7), 625‑631. https://doi.org/10.1016/S1957-2557(19)30194-4
[7] Temessek À, Sehli N, Tertek H, Khadraoui E, Jlassi H, Trabelsi N, et al. Fréquence du syndrome métabolique chez un groupe de diabétique type 2. Diabetes & Metabolism. mars 2012;38:A117.
[8] Abdesselem, H., Sebai, I., Jemal, M., Ounaissa, K., Kandara, H., Kammoun, I., Amrouche, C., & Ben Salem, L. (2018). Étude de la corrélation entre la sensibilité à l’insuline et les paramètres anthropométriques et métaboliques dans le diabète de type 2. Annales de Cardiologie et d’Angéiologie, 67(3), 167‑173. https://doi.org/10.1016/j.ancard.2018.04.021
[9] Nouri, A. (2017). Les anomalies des métabolismes lipidiques chez les diabétiques dans la wilaya de Bordj Bou Arreridj. http://depot.umc.edu.dz/handle/123456789/4866
[10] Azzouz, M., Guerchani, M. K., Hannachi, R., Yuergui, L., & Aissa, B. (2013). Les facteurs de risque du diabète de type 2 dans une population algéroise. Annales d’Endocrinologie, 74(4), 410. https://doi.org/10.1016/j.ando.2013.07.606
[11] Guira O, Tiéno H, Sagna Y, Mayodé P, Yanogo D, Zoungrana L, et al. Profil clinique du syndrome métabolique et facteurs associés à sa présence au cours du diabète de type 2 à Ouagadougou (Burkina Faso). Médecine des Maladies Métaboliques. févr 2016;10(1):70‑4.
[12] Ouhdouch, F., Oulad Sayad, N., & Diouri, A. (2009). P262 Fréquence du syndrome métabolique chez les diabétiques de type 2. Diabetes & Metabolism, 35, A88‑A89. https://doi.org/10.1016/S1262-3636(09)72060-9
[13] Marceline, Y. T., Issiaka, S., Gilberte, K. C., Nadège, R., Macaire, O. S., Arsène et al. Diagnostic et prévalence du syndrome métabolique chez les diabétiques suivis dans un contexte de ressources limitées: cas du Burkina-Faso. Pan Afr Med J déc 2014;19. pmc/articles/PMC4407947
[14] Chermat, R., & Malek, R. (2009). P208 Évaluation de l’HbA1c chez le diabétique de type 2. Diabetes & Metabolism, 35, A76. https://doi.org/10.1016/S1262-3636(09)72006-3
[15] Malek, R. (2011). Épidémiologie du diabète en Algérie : Revue des données, analyse et perspectives. Médecine des Maladies Métaboliques, 5(4), 29‑33. https://doi.org/10.1016/S1957-2557(11)70069-4
[16] Yaméogo, M.-T., & Drabo, J.-Y. (2016). Profil clinique du syndrome métabolique et facteurs associés à sa présence au cours du diabète de type 2 à Ouagadougou (Burkina Faso). Médecine des Maladies Métaboliques, 10(1), 70‑74. https://doi.org/10.1016/S1957-2557(16)30021-9
[17] Mimouni S, Azzouz M, Meftah A, Boudiba A. Profil du syndrome métabolique dans une population algéroise. Annales d’Endocrinologie. sept 2013 ;74 (4):457
[18] Djingri, L., Apollinaire, S., & Joseph, D. Y. (2014). Diagnostic et prévalence du syndrome métabolique chez les diabétiques suivis dans un contexte de ressources limitées : Cas du Burkina-Faso. The Pan African Medical Journal, 19. https://doi.org/10.11604/pamj.2014.19.364.3741
[19] Menik L, Palangasinghe S. Comparison of insulin resistance by indirect methods-HOMA, QUICKI and McAuley-with fasting insulin in patients with type 2 diabetes in Galle, Sri Lanka: A pilot study. Online Journal of Health and Allied Sciences. 2006; 5(1).
[20] Chang SA, Kim HS, Yoon KH, Ko SH, Kwon HS, Kim SR, et al. Body mass index is the most important determining factor for the degree of insulin resistance in non-obese type 2 diabetic patients in Korea. Metabolism. févr 2004;53(2):142‑6.
[21] Eckel, R. H., Grundy, S. M., & Zimmet, P. Z. (2005). The metabolic syndrome. Lancet (London, England), 365(9468), 1415‑1428. https://doi.org/10.1016/S0140-6736 (05)66378-7
[22] Delarue, J., Allain, G., & Guillerm, S. (2006). Le syndrome métabolique. Nutrition Clinique et Métabolisme, 20(2), 114‑117. https://doi.org/10.1016/j.nupar.2006.04.007
[23] Rochlani, Y., Pothineni, N. V., Kovelamudi, S., & Mehta, J. L. (2017). Metabolic syndrome : Pathophysiology, management, and modulation by natural compounds. Therapeutic Advances in Cardiovascular Disease, 11(8), 215‑225. https://doi.org/10.1177/1753944717711379
[24] Lee EY, Yang HK, Lee J, Kang B, Yang Y, Lee S-H, et al. Triglyceride glucose index, a marker of insulin resistance, is associated with coronary artery stenosis in asymptomatic subjects with type 2 diabetes. Lipids Health Dis. déc 2016; 15(1):155.
[25] Katz A, Nambi SS, Mather K, Baron AD, Follmann DA, Sullivan G, et al. Quantitative Insulin Sensitivity Check Index: A Simple, Accurate Method for Assessing Insulin Sensitivity In Humans. 2000;85(7):9.
[26] Zhu B, Wang J, Chen K, Yan W, Wang A, Wang W and al. A high triglyceride glucose index is more closely associated with hypertension than lipid or glycemic parameters in elderly individuals: a cross-sectional survey from the Reaction Study.Cadiovasc Diabetol 2020; 19:112 DOI.org/10.1186/s12933-020-01077-6.
[27] Unger G, Benozzi SF, Perruzza F, Pennacchiotti GL. Triglycerides and glucose index: A useful indicator of insulin resistance. Endocrinol Nutr. 1 déc 2014; 61(10):533‑40.
[28] Zhang Y, Ren L, Ren M, Yang H, Li K, Cong H, Guo Z. Correlation between the Triglyceride-Glucose-Index and high risk of cadiovascular disease: A cohort study of 102 061 subjects from Tianjin, China. Risk manag and Healthcare Policy 2021; 14: 2803-2810. DOI.org/10.2147 RMHP.S316484.