R. Zerarka, NS. Fedala
Service d’Endocrinologie et de Maladies Métaboliques, CHU Bab El Oued
Le syndrome métabolique se caractérise par la présence simultanée de plusieurs facteurs de risque cardiovasculaires dont le plus fréquent est l’hypertension artérielle. La morbi-mortalité cardiovasculaire du patient hypertendu se trouve majorée lorsque s’y associe un syndrome métabolique du fait de la présence d’un surpoids/obésité, d’une intolérance au glucose ou d’une dyslipidémie. Le choix de l’anti-hypertenseur optimal doit prendre en considération la présence de ces autres facteurs.
Introduction
Le syndrome métabolique (SM) est un ensemble de plusieurs facteurs de risque métaboliques avec l’association complète ou relative d’une hypertrophie du tissus adipeux abdominal, viscéral et sous cutané et d’une résistance à l’insuline, des troubles de l’intolérance au glucose, une dyslipidémie et d’une hypertension artérielle. Cet état entraîne un risque accru d’événements cardiovasculaires.
Il a été présenté pour la première fois en 1988 sous le nom de “syndrome X” par Reaven, où la résistance à l’insuline était la principale caractéristique physiopathologique et diagnostique [1].
Depuis, des modifications de cette définition ont été proposées par divers groupes d’experts, tandis que d’autres ont mis en doute sa pratique clinique (Tableau 1).
L’hypertension artérielle (HTA), est un problème majeur de santé publique, puisque selon l’OMS en 2021, 1,28 milliard de personnes dans le monde âgées de 30 à 79 ans en étaient atteintes. Celle-ci s’inscrit souvent dans le cadre de syndrome métabolique.
Cet article a pour but d’expliquer la relation reliant l’hypertension artérielle au syndrome métabolique et de souligner les recommandations utiles à notre pratique clinique quotidienne.
Définition du syndrome métabolique
La première tentative d’établir des critères pour le diagnostic du SD a été publiée par l’OMS en 1998. Le SD a été défini comme la présence d’une résistance à l’insuline et/ou d’un diabète de type 2 (DT2), d’une intolérance au glucose ou d’une altération de la glycémie à jeun combinée à au moins 2 des facteurs suivants : hypertension artérielle (HTA), dyslipidémie, obésité et microalbuminurie [2]. Cette définition présente des limites; elle exclut les patients non diabétiques et place l’insulino-résistance comme principal outil de diagnostic, bien que son utilisation en clinique soit difficile à mettre en œuvre. En outre, le traitement de l’HTA ou de la dyslipidémie a été exclu de la définition.
En 2001, le National Cholesterol Education Program Adult Treatment Panel III (NCEP ATP III) a proposé des critères diagnostiques différents. La présence d’au moins 3 de ces critères parmi : l’obésité abdominale, la dyslipidémie athérogène, l’hypertension artérielle ou de l’augmentation de la glycémie à jeun, était requise au diagnostic [3]. Contrairement à la définition précédente, toutes les composantes du syndrome étaient égales. La glycémie à jeun a été utilisée à la place de la résistance à l’insuline, tandis que la mesure du tour de taille a été proposée à la place du rapport taille-hanche ou de l’indice de masse corporelle. En conséquence, cette définition s’est avérée simple et plus applicable dans la pratique clinique quotidienne. Cependant, comme pour la définition précédente, les personnes sous traitement antihypertenseur ou hypo-lipémiant ont été exclues du diagnostic.
Quatre ans plus tard, deux autres définitions du SM ont été introduites. Celle proposée par l’American Heart Heart Association (AHA) et le National Heart, Lung, et du sang (NHLBI). Elles ressemblaient aux critères de l’ATP III, car toutes les variables étaient égales, mais avec quelques modifications. Le seuil de glycémie à jeun a été revu à la baisse, conformément aux lignes directrices de l’American Diabetes Association (ADA). Il a aussi été reconnu qu’un tour de taille plus bas pouvait être présent dans le SM, en particulier chez les personnes d’origine asiatique ou lorsque d’autres facteurs de risque coexistaient, tels que la stéatose hépatique non alcoolique (NAFLD), le syndrome des ovaires polykystiques, la microalbuminurie ou une CRP élevée. Enfin, les patients sous anti-hypertenseurs, hypo-glycémiants et hypo-lipémiants ont été inclus dans les critères de diagnostic [4].
Parallèlement, la Fédération internationale du diabète (FID) a proposé une autre définition du SM applicable dans le monde entier. Elle a suggéré d’utiliser différentes valeurs seuils pour le tour de taille en fonction de l’origine ethnique. Contrairement aux définitions précédentes, l’obésité abdominale est un élément central du diagnostic, associée à au moins deux des éléments suivants: glycémie à jeun élevée, triglycérides, taux de cholestérol et tension artérielle élevés, valeurs réduites de HDL-c, et ce, avec ou sans traitement [5].
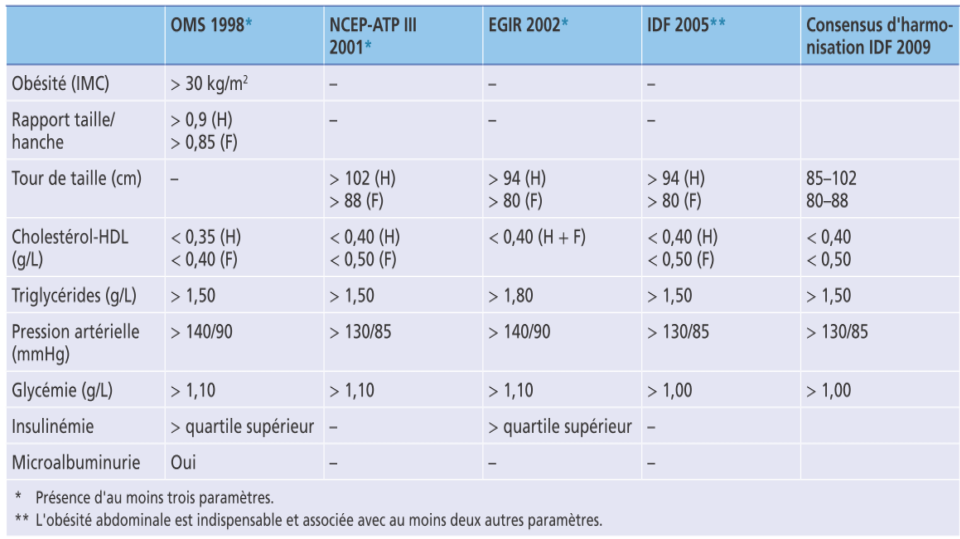
La définition la plus récente a été proposée en 2022 par la Polish Society of Hypertension en collaboration avec la Polish Society for the Treatment of Obesity [6]. Le diagnostic de SM est retenu devant :
- La présence d’une obésité abdominale (Tour de taille ≥ 88 cm chez la femme, et 102 cm chez l’homme) ou d’un indice de masse corporelle (IMC) ≥ 30 kg/m².
- Associée à deux des trois critères suivants :
- Prédiabète ou diabète : glycémie à jeun ≥ 1 g/l ou glycémie après test HGPO ≥ 1,4 g/l, ou HBA1c ≥ 5,7%, ou prise d’un traitement anti-diabétique.
- Taux de non-HDL cholestérol élevé ≥1,3 g/l ou prise d’un traitement anti-lipémiant.
- Hypertension artérielle ou tension artérielle normale haute : PAS ≥ 130 mmHg, et/ou PAD ≥85 mmHg, ou prise d’un traitement anti-hypertenseur.
Relation entre l’hypertension artérielle et le syndrome métabolique
La relation positive entre l’IMC et la pression artérielle systolique et diastolique a été décrite dès 1967 dans le cadre de l’étude de Framingham [7].
La prévalence de l’HTA associée à l’obésité varie avec l’âge, la race et le sexe et dépend aussi du seuil utilisé pour la définition de l’hypertension et l’obésité. Une étude menée sur la cohorte de Framingham indique qu’une prise de poids de 5 % a conduit à une augmentation de 30 % du risque de survenue d’une hypertension. Cette même étude a évalué les bénéfices de la perte de poids sur l’apparition de l’hypertension : dans les 4 années suivant le début de la surveillance, si la perte de poids était supérieure à 6,8 kg, le risque de survenue d’une HTA diminuait de 28% chez les sujets âgés de 30 à 49 ans et de 37 % chez ceux âgés de 50 à 65 ans [8].
Une prise de poids même modeste augmente l’incidence de l’HTA : sur une cohorte de 80 000 femmes suivies pendant 16 ans (The nurses’ health study), le risque de développer une HTA augmentait de 29% pour un gain de 2,1 à 4,9 kg et de 74% pour un gain de 5,0 à 9,9 kg [9].
La prévalence de l’HTA dans la population ayant un SM est élevée. Dans l’étude Pressioni Arteriose Monitorate E Loro Associazioni (PAMELA), chez les patients atteints de SM, l’HTA était la composante la plus fréquente de la maladie et était présente dans plus de 80% des cas [10].
À l’inverse, une proportion importante de patients hypertendus remplit les critères de diagnostic du SM. Dans le Progetto Ipertensione Umbria Monitoraggio Ambulatoriale (PIUMA), 34 % des patients hypertendus inclus présentaient également un SM. De plus, il a été démontré que ces patients présentaient davantage de maladies cardiovasculaires comparativement aux hypertendus ne présentant pas de SM [11].
En effet, la présence d’un SM est associée à un mauvais contrôle de la pression artérielle [12] et à l’apparition plus précoce et plus sévère d’atteinte d’organes cibles notamment une hypertrophie ventriculaire gauche, une microalbuminurie, une augmentation de l’épaisseur de l’intima-média et une rétinopathie hypertensive [13-16].
Mécanismes physiopathologiques
De nombreux mécanismes physiopathologiques ont été proposés à ce jour pour tenter d’expliquer le lien liant l’HTA au syndrome métabolique.
- Activation du système nerveux sympathique: l’insulino-résistance et l’obésité centrale sont associées à une augmentation de l’activité sympathique entraînant une accélération de la fréquence cardiaque, de la force de contraction ventriculaire, de la résistance vasculaire périphérique et de la rétention hydro-sodée. Toutes ces situations se combinent pour favoriser l’élévation de la pression artérielle [17].
- Activation du système rénine-angiotensine-aldostérone : Plusieurs travaux rapportent une corrélation positive entre l’IMC et les différents composants du système rénine-angiotensine [18]. Le tissu adipeux est un lieu de synthèse de l’angiotensinogène qui agit localement en favorisant la différenciation des adipocytes et en stimulant leur croissance. L’angiotensinogène produite par le tissu adipeux est convertie en angiotensine I sous l’effet de la rénine puis en angiotensine II sous l’effet de l’enzyme de conversion. L’angiotensine II est un puissant vasoconstricteur qui entraîne une élévation de la pression artérielle. Elle stimule également les glandes surrénales et donc la production d’aldostérone à l’origine d’une réabsorption plus importante de sodium par les reins et d’une hypervolémie. Il a été démontré que l’angiotensine II et l’aldostérone inhibent les voies de signalisation de l’insuline, favorisant l’insulino-résistance [19].
- Rôle de la leptine : La leptine est une cytokine produite par les adipocytes et sécrétée dans la circulation sanguine. Elle a entre autres pour rôle de réguler le comportement alimentaire et l’homéostasie énergétique par son action sur les récepteurs hypothalamiques. Sa concentration est élevée chez le sujet obèse. Eikelis et al. ont montré que des niveaux élevés de leptine étaient associés à une augmentation du tonus sympathique rénal chez le sujet obèse par conséquent au développement d’une HTA [20].
- Rôle de l’adiponectine : il s’agit d’une adipokine produite par les cellules adipeuses et sécrétée dans la circulation. Elle est diminuée chez les sujets obèses et au cours du diabète de type 2. Iwashima et al. Ont montré que la concentration d’adiponectine plasmatique était négativement corrélée au niveau de la pression artérielle chez des hypertendus [21].
- L’inflammation chronique de bas grade : associée à l’obésité et à l’insulino-résistance favorise le remodelage de la paroi vasculaire et l’augmentation de la fibrose diminuant ainsi sa plasticité. Elle engendre par ailleurs un dysfonctionnement endothélial. Ces facteurs entraînent une élévation persistante des pressions périphériques et de ce fait de la pression artérielle.
Définition de l’hypertension artérielle
Différentes définitions ont été établies par les sociétés savantes. Nous résumons les plus importantes dans le tableau 2
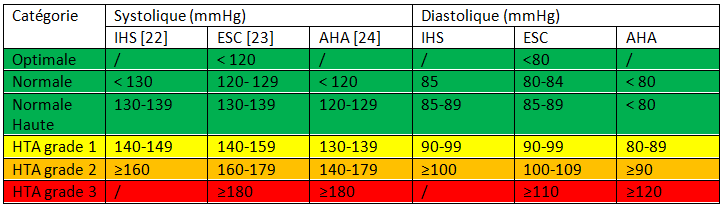
Ces seuils tensionnels sont établis sur des pressions artérielles humérales prises en consultation au cabinet médical, en respectant les conditions de prises :
- au calme, sans effort ni cigarette depuis 30 minutes, vessie vide, après 3 à 5 minutes de repos, ni patient ni médecin ne doit parler. Appareil de bras validé, brassard de taille adaptée, placé à hauteur du cœur, aux deux bras.
- À chaque consultation, deux mesures de PA doivent être enregistrées, espacées de 1 à 2 minutes, et retenir la moyenne des deux.
Mais depuis 2018, la majorité des sociétés savantes, dont l’ESC, recommande préférentiellement de dépister et poser le diagnostic de l’Hypertension artérielle sur des mesures faites en dehors du cabinet médical (« out of office BP »), sur mesure ambulatoire de la pression artérielle de 24 heures (MAPA ou ABPM), ou auto-mesures à domicile (HBPM), car celle-ci reflète mieux la réelle PA au quotidien, offre une meilleure corrélation aux complications de l’HTA, et est un meilleur marqueur pronostic de morbi-mortalité cardio-vasculaires [23].
Les guidelines donnent les seuils correspondant à 140/90 mmHg mesurés au cabinet médical :
- ABPM moyenne de 24 h : 130/80 mmHg
- ABPM moyenne diurne : 135/85 mmHg
- ABPM moyenne diurne : 120/70 mmHg
- HBPM : 135/85 mmHg
Une fois le diagnostic de l’HTA retenu, il est essentiel de dépister les autres facteurs de risque cardio-métaboliques afin de mieux stratifier le risque cardio-vasculaire de chaque patient, à savoir un trouble de l’équilibre glucidique, lipidique et une obésité (en mesurant l’IMC et le tour de taille). Aussi, il est primordial de rechercher le retentissement de l’HTA sur les organes cibles dès le diagnostic.
Traitement de l’HTA dans le cadre du syndrome métabolique
Les patients souffrant de surpoids ou d’obésité et d’hypertension artérielle sont exposés à un risque métabolique et cardiovasculaire plus accru que les hypertendus sans SM. Ils nécessitent un plus grand nombre de médicaments antihypertenseurs pour contrôler leur pression artérielle, et sont plus susceptibles d’être résistants [25]. Ceci devrait être pris en compte dans la prise de décision thérapeutique. Pourtant, les lignes directrices actuelles ne fournissent que peu de recommandations spécifiques pour cette population.
L’objectif principal est d’obtenir une réduction de la PA sans aggraver l’obésité et les risques métaboliques associés. Les guidelines de l’ESC/ESH recommandent de viser une pression artérielle systolique entre 120 et 129 mmHg chez les patients de moins de 70 ans et moins s’ils le tolèrent ; et une pression artérielle diastolique de moins de 80 mmHg. Chez les sujets de plus de 70ans, une pression artérielle de 130-139mm Hg est ciblée, et moins si tolérée.
Chez les patients atteints du syndrome métabolique, les inhibiteurs de l’enzyme de conversion de l’angiotensine (IEC), les inhibiteurs des récepteurs de l’angiotensine (ARA2) et les inhibiteurs calciques à longue durée d’action (IC) sont choisis en première intention. Aucune de ces classes de médicaments n’a d’effet délétère sur le métabolisme glucidique ou le contrôle du poids. L’inhibition du SRA peut avoir un effet bénéfique sur le métabolisme glucidique, mais n’empêche pas nécessairement la progression vers le diabète de type 2 [26,27].
Les diurétiques thiazidiques peuvent aggraver une intolérance au glucose de manière dose-dépendante [28].
Le traitement par bêta-bloquants favorise la prise de poids et le risque d’apparition d’un diabète (+ 28% dans l’étude ARIC) et devrait être limité à certaines indications (Fibrillation atriale, infarctus du myocarde, insuffisance cardiaque avec fraction d’éjection réduite ou la prévention secondaire après une maladie coronarienne). Les nouveaux béta-bloquants vasodilatateurs, tels que le carvédilol, le nébivolol et le labétalol, semblent épargner ces effets défavorables. Plus précisément, le carvédilol, un bêta-bloquant avec une action simultanée sur les récepteurs alpha-adrénergiques, a montré un meilleur profil métabolique que les agents traditionnels de cette catégorie [29]
L’antagoniste des récepteurs minéralocorticoïdes devrait être réservé au traitement de l’hypertension résistante (en dehors de l’indication spécifique du traitement de l’hyperaldostéronisme)
Alors que l’aliskiren, inhibiteur de la rénine, a été spécifiquement testé chez des patients obèses hypertendus [30], son rôle dans la prise en charge clinique n’est pas clair.
Conclusion
Le syndrome métabolique est un fléau mondial se caractérisant par la présence simultanée de multiples facteurs de risques cardiovasculaires. L’élévation de la pression artérielle en est la composante la plus fréquente. Cependant, jusqu’à présent, le traitement antihypertenseur optimal spécifique à cette catégorie de patient n’existe pas. En attendant le recueil de plus de données, le choix du traitement anti-hypertenseur doit tenir compte des différents mécanismes physiopathologiques et des effets secondaires des diverses classes thérapeutiques disponibles, notamment sur la prise de poids et sur le métabolisme glucidique.
Bibliographie
- Reaven GM. Role of insulin resistance in human disease. Diabetes. 1988; 37: 1595-607.
- Organization WH. Definition, diagnosis and classification of diabetes mellitus and its complications: Report of a WHO consultation. Part 1, Diagnosis and classification of diabetes mellitus. Geneva: World health organization, 1999.
- Expert Panel on Detection, Evaluation and T of HBC in A. Executive summary of the third report of the National Cholesterol Education Program (NCEP) expert panel on detection, evaluation, and treatment of high blood cholesterol in adults (Adult Treatment Panel III). J Am Med Assoc 2001; 285: 2486-97.
- Grundy SM, Cleeman JI, Daniels SR, et al. Diagnosis and management of the metabolic syndrome an American Heart Association/national heart, lung, and blood institute scientific statement. Circulation 2005; 112: 2735-52.
- International Diabetes Federation. The IDF consensus worldwide definition of the Metabolic Syndrome. Avilable at: https://www.idf.org/e-library/consensus-statements/60-idfconsensus-worldwidedefinitionof-the-metabolic-syndrome.html (2006, Accessed 18 October2018).
- Piotr Dobrowolski and al, Metabolic syndrome – a new definition and management guidelines. Arch Med Sci 2022; 18 (5): 1133–1156.
- Kannel WB, Brand N, Skinner JJ, Dawber TR, McNamara PM. The relation of adiposity toblood pressure and development of hypertension:The Framingham study. Ann Intern Med 1967;67:48-59.
- Vasan RS, Larson MG, Leip EP, Kannel WB, Levy D. Assessment of frequency of progression to hypertension in non-hypertensive participants in the Framingham Heart Study. Lancet 2001;358:1682-6.
- Huang Z, Willett WC, Manson JE, Rosner B, Stampfer MJ, Speizer FE et al. Body weight, weight change, and risk for hypertension in women. Ann Intern Med 1998;128:81-8.
- Mancia G, Bombelli M, Corrao G, et al. Metabolic syndrome in the Pressioni Arteriose Monitorate E Loro Associazioni (PAMELA) study: Daily life blood pressure, cardiac damage, and prognosis. Hypertension 2007; 49: 40-7.
- Schillaci G, Pirro M, Vaudo G, et al. Prognostic value of the metabolic syndrome in essential hypertension. J Am Coll Cardiol 2004; 43: 1817-22.
- Arcucci O, de Simone G, Izzo R, et al. Association of suboptimal blood pressure control with body size and metabolic abnormalities. J Hypertens 2007; 25: 2296-300.
- Cuspidi C, Meani S, Fusi V, et al. Metabolic syndrome and target organ damage in untreated essential hypertensives. J Hypertens 2004; 22: 1991-8.
- Leoncini G, Ratto E, Viazzi F, et al. Metabolic syndrome is associate with early signs of organ damage in nondiabetic, hypertensive patients. J Intern Med 2005; 257: 454-60.
- Mulè G, Nardi E, Cottone S, et al. Influence of metabolic syndrome on hypertension-related target organ damage. J Intern Med 2005; 257: 503-13.
- Athyros VG, Mikhailidis DP. High incidence of metabolic syndrome further increases cardiovascular risk in patients with type 2 diabetes. Implications for everyday practice. J Diabetes Complications2016; 30: 9-11.
- Schlaich M, Straznicky N, Lambert E, et al. Metabolic syndrome : A sympathetic disease? Lancet Diabetes Endocrinol 2015; 3: 148-58.
- Lamounier-Zepter V, Bornstein SR, EhrhartBornstein M. Mechanisms of obesity-related,hypertension. Horm Metab Res 2004;36:376-80
- Naha S, Gardner MJ, Khangura D, et al. Hypertension in Diabetes. [Updated 2021 Aug 7]. In: Feingold KR, Anawalt B, Blackman MR, et al., editors. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000
- Eikelis N, Schaich M, Aggarwel A, Kaye D, Esler M. Interaction between leptin and the human sympathetic nervous system. Hypertension 2003;41:1072-9
- Iwashima Y, Kutsuya T, Ishikawa K, Ouchi N, Ohishi M, Sugimoto K et al. Hypoadiponectinemia is an independent risk factor for hypertension. Hypertension 2004;43:1318-23.
- Thomas Unger, Claudio Borghi, Fadi Charchar, Nadia A. Khan, Neil R. Poulter, Dorairaj Prabhakaran, Agustin Ramirez, Markus Schlaich, George S. Stergiou, Maciej Tomaszewski, Richard D. Wainford, Bryan Williams and Aletta E. Schutte. 2020 International Society of Hypertension Global Hypertension Practice. Hypertension. 2020;75:1334–1357
- Williams B, Mancia G, Spiering W, Agabiti Rosei E, Azizi M, Burnier M, Clement DL, Coca A, de Simone G, Dominiczak A, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the Management Of Arterial Hypertension of the European Society of Cardiology and the European Society of Hypertension.J Hypertens. 2018; 36:1953–2041.
- Whelton PK, Carey RM, Aronow WS, Casey DE, Collins KJ, Dennison Himmelfarb C, DePalma SM, Gidding S, Jamerson KA, Jones DW, et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Hypertension. 2018; 71:1269–1324.
- Jordan J, Yumuk V, Schlaich M, Nilsson PM, Zahorska-Markiewicz B, Grassi G, et al. Joint statement of the European Association for the Study of Obesity and the European Society of Hypertension: obesity and difficult to treat arterial hypertension.JHypertens2012;30:1047–1055.
- McMurray JJ, Holman RR, Haffner SM, Bethel MA, Holzhauer B, Hua TA, et al. Effect of valsartan on the incidence of diabetes and cardiovascular events. N Engl J Med 2010; 362:1477–1490.
- Bosch J, Yusuf S, Gerstein HC, Pogue J, Sheridan P, Dagenais G,etal. Effect of ramipril on the incidence of diabetes. N Engl J Med 2006; 355:1551–1562.
- Savage PJ, Pressel SL, Curb JD, Schron EB, Applegate WB, Black HR, et al. Influence of long-term, low-dose, diuretic-based, antihypertensive therapyon glucose,lipid, uric acid,and potassiumlevelsin older men and women with isolated systolic hypertension: the SystolicHypertension in the Elderly Program. SHEP Cooperative Research Group. Arch Intern Med 1998; 158:741–751.
- Bakris GL, Fonseca V, Katholi RE, et al. Metabolic effects of carvedilol vs metoprolol in patients with type 2 diabetes mellitus and hypertension: A randomized controlled trial. J Am Med Assoc. 2004; 292: 2227-36.
- Jordan J, Engeli S, Boye SW, Le Breton S, Keefe DL. Direct renin inhibition with aliskiren in obese patients with arterial hypertension. Hypertension 2007; 49:1047–1055.