I. Benoumechiara, NS. Fedala.
Service d’Endocrinologie et Maladies Métaboliques, C.H.U Bab El Oued
Un hyperaldostéronisme primaire (HAP) est recherché devant une hypertension artérielle (HTA) présentant une des caractéristiques suivantes : sévère ; résistante ; associée à une hypokaliémie ; associée à un retentissement disproportionné sur les organes cibles, et devant un incidentalome surrénalien avec HTA ou hypokaliémie.
Le diagnostic positif repose sur des dosages hormonaux spécifiques de base qui reposent sur le rapport aldostérone/rénine (RAR) mesuré en conditions standardisées parfois complétés par des tests de stimulation de confirmation.
Le diagnostic étiologique repose sur l’imagerie des surrénales (Scanner ou IRM) avec parfois le recours au cathétérisme surrénalien avant la chirurgie afin de confirmer la sécrétion unilatérale de l’adénome visualisé à l’imagerie.
Le traitement est orienté en fonction de l’étiologie entre un traitement médical ou chirurgical dans une démarche de prise en charge multidisciplinaire et personnalisée des patients.
L’HAP est à l’origine d’une morbi-mortalité cardiovasculaire et d’un retentissement sur le métabolisme glucidique et lipidique qui ne fait qu’augmenter ce risque cardiovasculaire chez les patients.
Introduction
L’hyperaldostéronisme primaire (HAP) est décrit pour la première fois par le Dr Jérôme Conn en 1955, suite à la découverte chez une jeune femme de 34 ans, souffrant de crampes musculaires répétées, d’une hypokaliémie avec une élévation de l’aldostérone plasmatique ainsi qu’un nodule de la surrénale. Une guérison est obtenue après exérèse de cet adénome (1). Depuis, on sait que l´HAP peut être en rapport avec un adénome de Conn, une hyperplasie surrénalienne (uni ou bilatérale) ou dans de rares cas d’un corticosurrénalome (carcinome surrénalien). Sa prévalence est estimée entre 6 à 10 % des patients hypertendus (2), et constitue la première cause d’HTA secondaire (3)
Rappel physiologique
L’aldostérone est la principale hormone minéralo-corticoïde chez l’homme, de nature stéroïdienne (synthétisée à partir du cholestérol). Elle a été isolée en 1953 et sa structure élucidée en 1954 par les chercheurs Sylvia A. Simpson et James F. Tait (4). Cette hormone est sécrétée principalement par les cellules glomérulées du cortex surrénalien.
Elle est également synthétisée dans des proportions bien moins importantes au sein d’autres tissus, comme: l’encéphale, le cœur, ou les vaisseaux sanguins. (5)
Son rôle est essentiel dans le maintien de l’homéostasie sodique et potassique. Elle est impliquée dans un certain nombre de pathologies chez l’homme, en particulier
l’hypertension artérielle et l’insuffisance cardiaque. (6)
Comme tous les autres stéroïdes, l’aldostérone est synthétisée à partir du cholestérol.
Sa synthèse requiert, comme pour les autres hormones stéroïdiennes, une cascade de réactions enzymatiques (Figure 1).
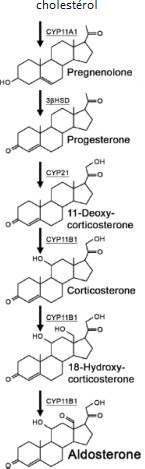
D´après Dumont, 2018
Les cellules du cortex n’ont pas la capacité de stocker les hormones synthétisées. L’aldostérone est donc sécrétée immédiatement après sa synthèse dans le courant circulatoire. L’affinité de l’aldostérone pour les protéines
plasmatiques de liaison (Albumine, Corticosteroid Binding Globulin) est relativement basse.
La sécrétion d’aldostérone est stimulée par une déplétion réelle ou apparente du volume sanguin détectée par les récepteurs d’étirement et par une augmentation des concentrations sériques d’ions potassium ; elle est supprimée par l’hypervolémie et l’hypokaliémie.
Les mécanismes de régulation de la sécrétion d’aldostérone sont complexes, impliquant la zona glomérule des glandes surrénales, l’appareil juxta-glomérulaire dans les reins, le système cardiovasculaire, le système nerveux autonome, les poumons et le foie (Figure2). (7)
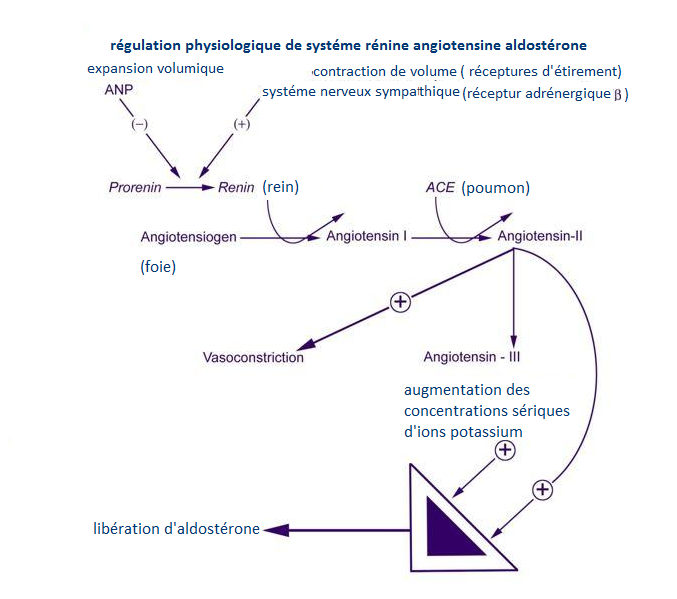
ANP : peptide natriuritique auriculaire ; ACE : enzyme de conversion
La régulation de la sécrétion de l’aldostérone se produit donc au niveau de sa synthèse. Deux facteurs majeurs veillent à la régulation de l’aldostérone ; L’angiotensine II (AngII) et le taux de potassium plasmatique, tandis que l’ACTH participe à la régulation de l’aldostérone dans une moindre mesure.
L’aldosterone peut agir par voie génomique ou non génomique (8) :
Mode d’action génomique
Les cibles classiques de l’aldostérone sont les tissus épithéliaux comme le rein, le colon, les glandes salivaires et les glandes sudoripares, où il agit par voie génomique.
Mode d’action non génomique
L’aldostérone peut interagir avec d’autres tissus : Système cardiovasculaire et système nerveux central.
Les effets de l’aldostérone chez l’homme (L AMAR, 2012) sont principalement un rôle très important dans la balance hydrosodée. L’aldostérone favorise la rétention du sodium (Na+) et l’excrétion de potassium (K+) et d’ions H+ par le rein, conduisant ainsi à la réabsorption passive de l’eau. L’aldostérone contribue à la régulation directe de la natrémie et de la kaliémie, et à la régulation indirecte de la volémie et de la pression artérielle (9).
L’aldostérone peut exercer d’autres effets sur d’autres tissus (10) :
Au niveau du système nerveux central, elle régule la pression artérielle, la faim et la soif.
Au niveau du système cardiovasculaire, elle régule notamment de la pression artérielle. Ces actions peuvent avoir des effets délétères à long terme.
Rappel physiopathologique
L’hyperaldostéronisme primaire (HAP) est défini comme la production autonome excessive et inappropriée d’aldostérone par les glandes surrénales, échappant au contrôle du SRAA (système rénine- angiotensine). Il s’exprime habituellement par une hypertension artérielle avec hypokaliémie, une diminution de la rénine plasmatique avec augmentation de l’aldostérone.
A. L’hypertension artérielle est la conséquence de la stimulation des récepteurs des minéralocorticoïdes dans les tubes collecteurs du cortex rénal. Ceci provoque l’ouverture des canaux sodiques conduisant à une réabsorption tubulaire accrue de sodium et une réabsorption secondaire de l’eau. La sécrétion et l’excrétion urinaire de potassium et des ions hydrogène sont également augmentées. La rétention du sel et de l’eau provoque une augmentation du volume plasmatique et une augmentation du débit cardiaque, entraînant une augmentation de la pression artérielle et une suppression de la production de rénine. (11)
En cas d’HAP, l’expansion volémique qui résulte de la réabsorption distale excessive de sodium entraîne une diminution de la réabsorption proximale du sodium par le biais d’une augmentation de la production d’ANP. Ce phénomène d’échappement explique l’absence d’œdème dans les HAP. (12)
L’HTA est à l’origine d’une morbi-mortalité cardiovasculaire, sans oublier l’effet direct de l’aldostérone en Excès qui favorise au sein du système cardiovasculaire l’hypertrophie cardiaque, la fibrose, et un dérèglement du fonctionnement de l’endothélium vasculaire. (13)
B. Les troubles métaboliques
De nombreuses preuves suggèrent que l’HAP est associé à plusieurs caractéristiques du syndrome métabolique, en particulier à l’obésité, au diabète sucré de type 2 et à la dyslipidémie. Plusieurs études ont également montré les effets délétères de l’excès aldostérone au niveau métabolique (17) (MONTICONE et al, 2017.
Conséquences cardio-vasculaires de l’HAP
L’HAP est l’une des causes les plus fréquentes d’hypertension artérielle curable (12).
Après que les premiers cas d’HAP ont été décrits et caractérisés par Conn, un ensemble substantiel de preuves expérimentales et cliniques sur les effets à long terme de l’excès d’aldostérone sur le système cardiovasculaire a été recueilli au cours des 5 dernières décennies (13).
Les patients souffrant d’hypertension présentent une forte prévalence d’anomalies métaboliques concomitantes, notamment l’obésité, la dyslipidémie et l’hyperglycémie. Le regroupement de ces facteurs de risque cardiovasculaire, défini comme un syndrome métabolique (14).
Le taux plus élevé d’événements cardiovasculaires rapporté dans l’HAP que dans l’hypertension artérielle essentielle pourrait être dû à une prévalence accrue du syndrome métabolique dans la première condition (15).
La répartition des composantes individuelles du syndrome métabolique autre que l’hypertension a montré que l’hyperglycémie était significativement plus fréquente dans l’HAP que dans l’hypertension essentielle avec une prévalence du 10 à 50 % d’intolérance au glucose et/ou de diabète (14).
L’HAP peut donc engendre une augmentation du risque cardio-vasculaire attesté par une élévation de la morbi-mortalité des par HAP. (12).
Les patients atteints d’HAP présentaient une augmentation significative du risque relatif de :
L’hypertrophie ventriculaire gauche (HVG), l’insuffisance cardiaque, l’arythmies, l’infarctus du myocarde et de fibrillation auriculaire, ainsi un épaississement de l’intima-media carotidienne et l’altération des fonctions endothéliales, l’aldostérone a également induit des changements dans la matrice extracellulaire, entraînant un dépôt de collagène, suivi par l’artériosclérose et la fibrose myocardique (16).
Le traitement de l’HAP qu’il soit médical ou chirurgical a réduit le risque d’événements cardiovasculaires.
Conséquences métaboliques de l´HAP
A. HAP et diabète sucré
L’HAP est fréquemment associé à un diabète de type 2 chez les sujets hypertendus : Une élévation de glycémie et un développement d’une résistance à l’insuline qui s’avèrent être réversibles suite au traitement de l’hyperaldostéronisme (médical ou chirurgical).
Y. HU et al 2020 ont trouvé que la prévalence de l’HAP chez les nouveaux patients atteints de DT2 souffrant d’hypertension est d’au moins 19 %. L´aldostérone plus élevée peut être liée à une résistance à l’insuline chez les patients diabétiques (17).
Le mécanisme de diabète type 2 au cours de l´HAP est complexe ; au cours de la prise pondérale se développe une insulinorésistance corrélée aux concentrations plasmatiques d’aldostérone. D’autres anomalies immunitaire et inflammatoire retrouvées au cours de l’obésité peuvent être également impliquées (18, 19, 20).
Par ailleurs, la restriction sodée en activant le système rénine-angiotensine-aldostérone, renforce la résistance à l’insuline (19).
L’aldostérone en excès réduit la sensibilité à l’insuline et affecte les différentes voies de signalisation cellulaire de l´insuline ainsi que le transport de glucose ; il a été suggéré qu’il augmente la production hépatique de glucose. Il diminue également la sécrétion d’insuline par action directe sur les cellules pancréatiques et via l’hypokaliémie qui peut être observée au cours de l’HAP (19,20).
À l’inverse, le traitement par spironolactone augmente les taux de peptide C, ce qui révèle l’effet bénéfique du blocage du MR sur la sécrétion d’insuline. La baisse de la fonction β-pancréatique induite par l’aldostérone contribue donc au développement du diabète de type 2 chez les patients obèses (18, 19, 20).
B. HAP et obésité (33 34)
Le lien entre le taux d’aldostérone plasmatique et l’IMC chez des individus (normotendus et hypertendus) est controversé selon les études. L’étude de Dudenbostel et alsur une cohorte de 2 170 patients présentant une hypertension résistante et un IMC entre 15 et 74 kg/m2 a permis de démontrer l’existence d’un lien entre l’obésité et la fonction minéralocorticoïde, permettant d’envisager la production par le tissu adipeux de substances stimulatrices de la synthèse d’aldostérone ; les hommes ont eu des taux d’aldostérone plasmatique plus élevés et une corrélation de l’aldostérone avec l’IMC plus forte que les femmes(19). L´a différence entre les 2 sexes pourrait être expliquée selon les auteurs (E. Louiset et AG. Lopez- 2018) par la différence dans le rôle de l’adiposité viscérale, plus importante chez les hommes, et pourrait produire davantage de facteurs stimulant la fonction minéralocorticoïde que le tissu adipeux sous-cutané
C. HAP et dyslipidémie
Concernant les anomalies lipidiques ; le mécanisme est incomplètement élucidé ; une possible implication de l’insulinorésistance et les modifications de débit de filtration glomérulaire ont été évoquées. HANSLIK et al (2015) n´ont pas trouvé de différence statistiquement significative en matière de cholestérol total, de cholestérol LDL ou de triglycérides entre les patients souffrant d’HAP et les patients hypertendus essentiels, mais les taux de cholestérol HDL étaient plus élevés dans ce dernier (18).
D’autres auteurs tels que SJ Moon et al (2021) qui ont trouvé des résultats différents de profil lipidique chez les patients ayant un HAP des taux de cholestérol total ; non -HDL et triglycérides plus bas (21)
D. HAP et stéatose hépatique non alcoolique (NAFLD)
La prévalence élevée de NAFLD dans l´HAP, Fallo et al ont montré à l’examen échographique que la prévalence de la NAFLD est significativement plus élevée chez les patients atteints d’HAP que chez les sujets normotendus. Le mécanisme avancé est l’implication de l’insulinorésistance et de l’obésité abdominale observées dans l´HAP (22).
E. HAP et Syndrome d’apnée obstructive du sommeil (SAHOS)
L’association entre SAOS et hypertension est probablement bidirectionnelle. Cette association est liée, en partie, à une forte prévalence de l’hyperaldostéronisme chez les patients atteints d’hypertension artérielle résistante. Des études ont montré que la prévalence du SAOS chez les sujets hypertendus avoisine approximativement 20 à 40 %, tandis qu’elle atteint 70 à 85 % chez les sujets souffrant d’HTA résistante. Les niveaux d’aldostérone plasmatique sont corrélés positivement à la sévérité du SAHOS, ce qui suggère un possible mécanisme physiopathologique sous-jacent commun (19,23).
Les hypoxies nocturnes intermittentes survenant au cours du sommeil s’accompagnent d’élévations répétitives de l’activité du système nerveux sympathique connue pour stimuler le système rénine-angiotensine-aldostérone. L’excès d’aldostérone semble contribuer à la rétention d’eau et à l’œdème du nasopharynx, entraînant l’obstruction de la partie supérieure des voies respiratoires, par augmentation des pressions à ce niveau (23). l´Endocrine Society recommande de chercher l´HAP chez les personnes présentant un SAHOS (24).
Conclusion
L´HAP expose à un risque cardiovasculaire non négligeable et les altérations métaboliques secondaires à la surproduction d’aldostérone ne peuvent que l’aggraver. Les troubles métaboliques peuvent être améliorés voir corrigés par le traitement de l´HAP. Le diagnostic de l’HAP aux premiers stades de la maladie et l’instauration précoce d’un traitement spécifique sont nécessaires pour réduire la morbi-mortalité liée à cette pathologie.
Bibliographie
(1)JW Conn. Presidential address. I. Painting background. Primary aldosteronism, a new clinical syndrome. J Lab Clin Med 1955 ;45(1) :3–17.
(2)L Ammar. Primary aldosteronism following the guidelines. Mises au point cliniques d’Endocrinologie 2017.
(3)M Araujo-Castro, P Parra-Ramírez. Diagnosis of primary hyperaldosteronism. Medicina clinica 2022 ; 158 (9) : 424-430
(4)J. S Williams. “50th Anniversary of Aldosterone.” Journal of Clinical Endocrinology & Metabolism 2003 ; 88 : 2364-2372.
(5)R.C. Gaillard. Aldostérone et cœur1 La Lettre du Cardiologue 2007 ;405.
(6)R.C. Gaillard Aldostérone et cœur. Métabolismes Hormones Diabètes et Nutrition (X) 2006 ; 6.
(7)GP Chrousos et al. Hyperaldosteronism. Medscape 2020.
(8)M. Lombès, M.C. Zennaro. Nouveaux impacts de l’aldostérone dans le système cardiovasculaire Act Méd Int – Métabolismes – Hormones – Nutrition 2000 ;4 (3)
(9)L Amar. Identification de nouvelles options thérapeutiques et diagnostiques dans l’hyperaldostéronisme primaire 2012.
(10)McEneaney, V., B. J. Harvey and W. Thomas. “Aldosterone rapidly activates protein kinase D via a mineralocorticoid receptor/EGFR trans-activation pathway in the M1 kidney CCD cell line.” J Steroid Biochem Mol Biol 2007 ; 107(3-5): 180-190
(11)M. Lombès, M.C. Zennaro. Nouveaux impacts de l’aldostérone dans le système cardiovasculaire Act Méd Int. – Métabolismes – Hormones – Nutrition 2000 ;4 (3)
(12)X Wu, J Yu, H Tian. Cardiovascular risk in primary aldosteronism A systematic review and meta-analysis. Medicine 2019 ; 98 :26
(13) E. Warchoł-Celińska1, J. W. M. Lenders, A. Januszewicz et al. Aldosteronism and Cardiovascular Risk. Horm Metab Res 2015 ; 47 : 973–980.
(14)F Fallo et al. Prevalence and characteristics of the metabolic syndrome in primary aldosteronism. J Clin Endocrinol Metab 2006.
(15)C Pilon, R Urbanet. Aldosterone and Metabolic Syndrome. Horm Metab Res 2012 ; 44 : 208–214
(16)X lin, MHE Ullah, X Wu, F Xu, S Shan, ML lei et al. Cerebro-Cardiovascular Risk, Target Organ Damage, and Treatment Outcomes in Primary Aldosteronism. Front Cardiovasc Med 2021 ; 8.
(17)Y Hu, J Zhang, W Liu, X Su. Determining the Prevalence of Primary Aldosteronism in Patients With New-Onset Type 2 Diabetes and Hypertension. J Clin Endocrinol Metab 2020 ;105(4)
(18)Hanslik G, Wallaschofski H, Dietz A, Riester A, Reincke M, Allolio B, et al. Increased prevalence of diabetes mellitus and the metabolic syndrome in patients with primary aldosteronism of the German Conn’s Registry. Eur J Endocrinol2015 ; 173 :665–75
(19) Louiset, AG Lopez. Mécanismes physiopathologiques de l’hyperaldostéronisme au cours du syndrome métabolique. Correspondances en Métabolismes Hormones Diabètes et Nutrition 2018 ; 12(8)
(20)Ref JM Luther. Effects of aldosterone on insulin sensitivity and secretion. Steroids 2014 ; 0 :54-60
(21)SJ Moon ; HN Jang ; JH kim ; MK Moon. Lipid Profiles in Primary Aldosteronism Compared with Essential Hypertension : Propensity-Score Matching Study. Endocrinol Metab (Seoul) 2021 ; 36(4) : 885–894
(22)F Fallo QD Poza M Tecchio F Tona N Sonino M Ermani. Nonalcoholic fatty liver disease in primary aldosteronism: a pilot study.Am J Hypertens 2010; 23(1):2-5
(23)A Prejbisz, S kolodziejczyk- kruk, JZM Lenders, Q Januszewicz. Primary aldosteronism and obstructive sleep apnea. Horm Metab Res 2017; 49: 969–976
(24)XJ Funder, RM Carey, F Mantero , MH Murad, M Reinke, H Sheibata et al. The management of primary aldosteronism : Case detection, diagnosis, and treatement. An Endocrine Society clinical practice guidline. J Clin Enodcrinol Metab 2016 ; 101 : 1889-1916