A. Adimi, NS. Fedala
Service d’Endocrinologie et de Maladies Métaboliques, CHU Bab El Oued
Le syndrome métabolique, également connu sous le nom de syndrome d’insulinorésistance, consiste en l’association chez un même individu, d’un certains nombre de facteurs de risque cardio-vasculaires. L’IDF (International Diabetes Federation) est la seule organisation majeure à avoir établi une définition pédiatrique du syndrome métabolique. Il est à l’origine d’une morbimortalité cardiovasculaire précoce.
Introduction
L’obésité infantile constitue un problème de santé publique. Il s’agit d’une véritable épidémie mondiale car le nombre d’enfants et d’adolescents atteints a triplé, voire quadruplé pendant les dernières décennies. Selon les données de l’OMS, en 2019, on estime que 38,2 millions d’enfants de moins de 5 ans étaient en surpoids ou obèses. Plus de 340 millions d’enfants et d’adolescents âgés de 5 à 19 ans étaient en surpoids ou obèses en 2016. (1)
Parallèlement à cette évolution, le diabète et d’autres facteurs de risque cardiovasculaires (HTA, dyslipidémie), sont de plus en plus fréquents et constituent une réelle préoccupation, surtout lorsqu’elles touchent l’enfant et l’adolescent.
Définitions du syndrome métabolique chez l’enfant et l’adolescent
Plusieurs chercheurs ont élaboré des définitions du syndrome métabolique avec certaines valeurs seuils variables selon l’âge et d’autres paramètres comme le sexe ou la taille. Mais cela suppose l’existence dans certains cas de courbes de référence en percentiles spécifiques à chaque ethnie. Earl et coll ont rapporté l’existence de 46 définitions de l’enfant entre 1998 et 2006, dont 28 utilisent le modèle de la NCEP ATP III, 9 celui de l’OMS, 3 celui de l’EGIR (2). [tableau 2]
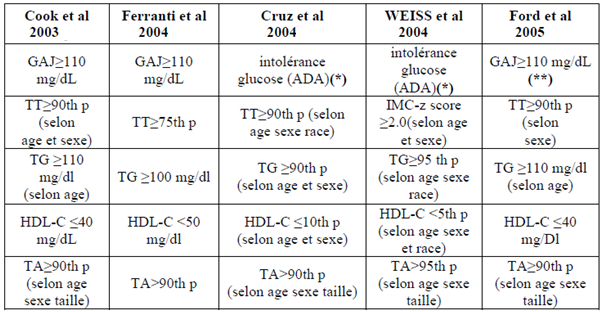
Les 5 définitions ont adapté le modèle de la NCEP ATP III de l’adulte à l’enfant, le syndrome métabolique est diagnostiqué par la présence de 3 critères sur les 5. En 2007, 2 nouvelles définitions ont été publiées, la première était celle de Jollife et al qui concerne les adolescents âgés de 12 ans et 19 ans, dont les valeurs seuils sont liées à la fois à celles de l’IDF et la NCEP ATP III de l’adulte, mais avec des variations selon l’âge et le sexe (8). Cette définition n’utilise pas de percentiles par rapport aux précédentes. mais fournit des valeurs seuils universellement applicables. La seconde définition publiée en 2007 était celle de l’IDF pour l’enfant, la seule établie par une organisation majeure [9]:
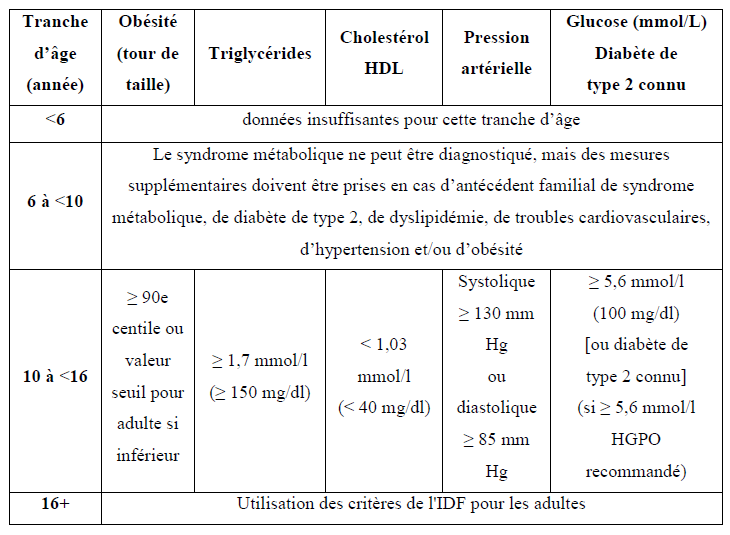
L’IDF considère qu’un individu entre 10 et 16 ans est atteint de syndrome métabolique s’il a un tour de taille >90e percentile, en plus d’au moins 2 autres critères.
On constate que cette définition limite le diagnostic de ce syndrome aux individus âgés de 10 ans et plus. Elle présente également de nombreuses similitudes avec celle de l’adulte, puisque les valeurs seuils sont les mêmes à l’exception de la valeur unique du taux de cholestérol HDL pour les 2 sexes chez l’enfant, au lieu d’une distinction selon le sexe pour l’adulte. Pour le tour de taille, il se caractérise par un seuil selon l’âge, le sexe et la race pour l’enfant ; Chez l’adulte, seuls sont considérés le sexe et la race.
Le tour de taille est plus considéré que l’IMC puisque ce dernier paramètre n’est utilisé que par la définition de WEISS [6]. De plus, l’élévation du tour de taille est un critère obligatoire dans la définition la plus récente de l’IDF (9). Plusieurs travaux ont souligné la supériorité du périmètre ombilical par rapport au BMI (body mass index) pour évaluer le risque cardiovasculaire, [10, 11].
Physiopathologie du syndrome métabolique
Le syndrome métabolique trouve son origine dans le désordre métabolique appelé “insulino résistance“, dû à la fois à des facteurs génétiques (comme le polymorphisme des gènes PPAR γ et de l’adiponectine) et des facteurs acquis liés à l’environnement tel que la sédentarité et la nutrition, mais aussi à l’obésité viscérale.
Cette insulinorésistance se définit par une incapacité des tissus cibles (foie, muscles, tissu adipeux, endothélium) à répondre de manière adéquate à l’action de l’insuline.
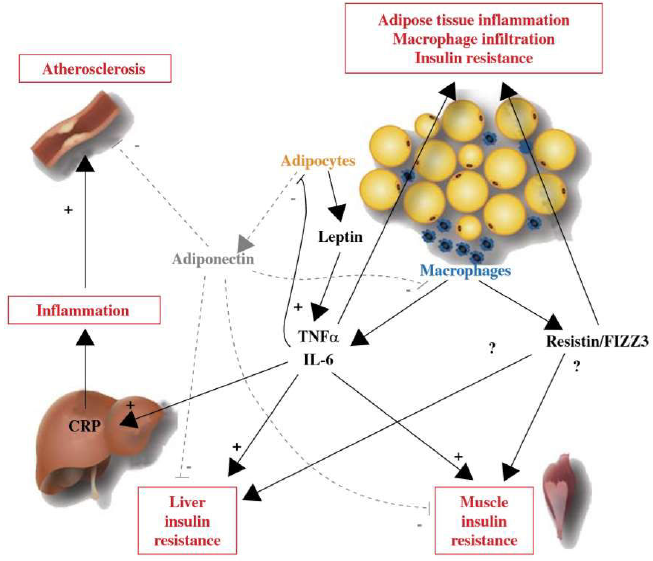
Le tissu adipeux semble occuper une place centrale dans les désordres observés. Les modifications du tissu adipeux sont responsables d’anomalies de concentration plasmatique de plusieurs cytokines pro-inflammatoires, en particulier une augmentation des IL6, de TNF α et une diminution de la concentration d’adiponectine.(12)
L’excès de production de TNF α semble être particulièrement délétère. L’augmentation du volume des adipocytes du tissu adipeux abdominale s’accompagne d’un excès de sa production qui modifie l’action de l’insuline au niveau du tissu adipeux ; Il en résulte une dérégulation de l’activité de la lipase hormonosensible à l’origine d’une libération importante d’acides gras libres dans le sang. Ces acides gras circulants sont captés par les hépatocytes et les myocytes où ils vont s’accumuler. Cet excès d’acides gras induit une insulinorésistance de ces tissus : au niveau de l’hépatocyte il y a une incapacité à limiter l’action du glucagon sur la néoglucogenèse et sur la glycogénolyse. Au niveau musculaire, on observe une altération des transporteurs du glucose. Cet état d’insulinorésistance entraîne une augmentation de la production d’insuline par le pancréas pour maintenir l’homéostasie glucidique.(13)
L’hyperinsulinisme secondaire à l’insulinorésistance, associé à la lipotoxicité des acides gras sur le pancréas, finit par provoquer un déficit de la sécrétion d’insuline. En parallèle, apparaît une hyperglycémie initialement post prandiale puis à jeun définissant le diabète de type 2.
Le catabolisme des chylomicrons et des VLDL (Very Low Density Lipoprotein) est réduit en raison d’une baisse de l’activité de la lipoprotéine lipase induite par l’augmentation de TNF α et d’IL 6. Ceci conduit à l’accumulation de particules riches en triglycérides et en apoprotéines A. Par ailleurs, au niveau du foie, l’excès d’acides gras estérifiés favorise la synthèse des particules VLDL riches en triglycérides et en apoprotéines B; Il en résulte une augmentation de la triglycéridémie. Une partie des triglycérides produits en excès reste dans le tissu hépatique, favorisant l’apparition d’une stéatose hépatique avec perturbation du bilan hépatique, pouvant conduire à un NASH syndrome (Non Alcoholicsteato-hepatitis). L’accumulation plasmatique de VLDL riche en triglycérides favorise l’échange de triglycérides et de cholestérol entre les VLDL et les HDL, ceci sous l’influence d’une protéine de transfert appelée CETP (cholesteryl-Ester-Transfer-Protein). Il en résulte, l’accumulation dans le plasma des HDL enrichies en triglycérides qui sont rapidement hydrolysées par la lipase hépatique dont l’activité est augmentée en cas d’insulinorésistance. Ce phénomène conduit à la formation de particules HDL de petite taille et denses, qui sont plus rapidement catabolisées par le foie que les particules HDL de taille standard. Ainsi il semble que ce soit l’hypertriglycéridémie qui entraîne un hypercatabolisme des HDL. Néanmoins, certains patients insulinorésistants présentent un taux d’HDL bas sans hypertriglycéridémie. Cela pourrait s’expliquer par l’augmentation d’activité de la CETP et de la lipase hépatique, indépendamment de la triglycéridémie en cas d’insulinorésistance (12).
Plusieurs hypothèses peuvent expliquer l’élévation de la tension artérielle lors de l’insulinorésistance(14) :
- L’insuline augmente l’activité du système sympathique hypertenseur.
- L’insuline est un vasodilatateur qui a pour effet d’augmenter la résorption du sodium rénal; en cas d’insulinorésistance, cet effet dilatateur peut être perdu mais l’effet rénal préservé.
- L’effet possible de certains marqueurs d’insulinorésistance. [15].
Complications cardio-vasculaires de l’obésité chez l’enfant
Existe-t-il des complications cardiovasculaires précoces de l’obésité chez l’enfant ? Peut-on prévenir les complications cardiovasculaires liées à l’obésité dès l’enfance ?
Beaucoup évoquent une épidémie d’obésité infantile qui menace l’avenir cardiovasculaire mondial, dans la mesure où la majorité des enfants obèses le restent à l’âge adulte (18). Les actions de prévention destinées aux plus jeunes se multiplient, les médecins sont encouragés à dépister et à prendre en charge le plus tôt possible les enfants obèses, et la recherche systématique de facteurs métaboliques de risque cardiovasculaire est recommandée dès l’enfance. Mais toutes ces mesures sont-elles vraiment justifiées ?
A. Altérations artérielles et cardiaques dés l’enfance chez l’obèse
On sait maintenant, depuis presque 20 ans, que l’obésité entraîne des anomalies de la mécanique artérielle et de la fonction endothéliale, premières manifestations de l’athérosclérose mesurée par échographie de haute résolution, dès l’enfance (19).
La plupart des facteurs métaboliques responsables des complications cardiovasculaires de l’adulte obèse sont également corrélés chez l’enfant à ces altérations artérielles. Ceci suggère qu’elles ont un effet délétère dès cet âge (19, 20). Effectivement plusieurs études ont confirmé cette hypothèse, en mettant en évidence chez l’enfant obèse des anomalies vasculaires (diminution de l’élasticité artérielle, augmentation de l’épaisseur intima et média, dysfonction endothéliale…) [21,22, 23] et/ou cardiaques (hypertrophie ventriculaire gauche…) [24] qui pourraient être les premières manifestations d’une maladie vasculaire et/ou d’une cardiopathie qui s’exprimeraient plus tard à l’âge adulte.
En effet la présence de lésions d’athérosclérose précoce a été décrite à plusieurs reprises chez les jeunes, à l’image des stries lipidiques qui peuvent se voir dès l’âge de 10 ans et des plaques d’athérome avant l’âge de 20 ans [25 , 26, 27, 28]. Trois grandes études nord-américaines: la Bogalusa HEART Study[29], la Muscatine Study [30]et la PDAY (Patho-biological Determinants of Atherosclerosis in Youth)[31] ainsi que deux études européennes: A cardiovascular risk in Young Finns Study[32]et l’ARYA Study (Atherosclerosis Risk in Young Adults) [33] ont confirmé que les lésions d’athérosclérose se constituent tôt (dès l’adolescence) et d’autant plus vite qu’ il y’ a un ou plusieurs facteurs de risque cardiovasculaire [29].
Par ailleurs la sévérité de ces lésions est liée à la présence de chacun de ces facteurs de risque cardio-vasculaires et à leur nombre en particulier l’intolérance au glucose, mais également l’insulinorésistance puisque différentes études ont démontré une relation significative entre ces derniers et l’épaisseur de l’intima média de la carotide (indicateur de la présence et de la sévérité de l’athérosclérose) [34, 35,36]
Concernant les anomalies cardiaques précoces comme l’hypertrophie ventriculaire gauche, celle-ci a pu être observée chez 41% d’enfants avec hypertension artérielle (37). Dans l’étude de Litwin et al, les enfants avec hypertension artérielle primitive et hypertrophie ventriculaire gauche avaient significativement plus d’anomalies des paramètres du syndrome métabolique [37].
De plus en plus de preuves suggèrent que l’obésité dans la petite enfance peut affecter de manière significative la géométrie et la fonction cardiaque (38). Plusieurs études ont indiqués une augmentation de la masse ventriculaire gauche (VG), de la taille de l’oreillette gauche et une altération de la fonction diastolique VG chez les enfants obèses par rapport aux non obèses (39, 40).
La fonction diastolique du VG reste un marqueur précoce de remodelage cardiovasculaire ; Une méta analyse récemment publiée, ayant inclus 70 études (9983 patients) , a démontré que l’obésité chez l’enfant et l’augmentation de l’indice d’insulino résistance( HOMA IR), étaient associées à une altération de la fonction diastolique du VG (41) .
Il est donc important de savoir si ces lésions artérielles et cardiaques précoce sont irréversibles et, donc, potentiellement responsables d’accidents cardiovasculaires et d’insuffisance cardiaque à l’âge adulte quelle que soit l’évolution pondérale de l’enfant, ou au contraire réversibles entraînant une morbi mortalité cardiovasculaire ultérieure accrue uniquement si l’obésité persiste.
B. Obésité durant l’enfance et risque cardiovasculaire à l’âge adulte
Dans une étude américaine longitudinale ancienne effectuée sur plus de 50 ans, A. Must et al. (42) ont montré que l’obésité à l’adolescence multipliait, chez les hommes mais pas chez les femmes, les risques de mortalité par maladies coronariennes ou par accident vasculaire cérébral par 2 et 13 respectivement, indépendamment du niveau socioéconomique, de la présence d’autres facteurs de risque vasculaire et, surtout, de l’évolution pondérale. Cette étude semblait ainsi confirmer le lien direct entre la présence d’une obésité chez l’adolescent et la survenue de complications cardiovasculaires plusieurs décennies plus tard, même lorsque les individus n’étaient plus obèses à l’âge adulte. Vingt-quatre ans plus tard, une étude israélienne similaire confirmait que l’obésité à l’adolescence augmentait le risque de mortalité cardiovasculaire au cours des 40 années suivantes, sans toutefois démontrer que ce risque était indépendant de l’évolution pondérale au-delà de l’adolescence (43). Enfin, 2 importantes études de suivi de cohortes d’enfants américains (The Bogalusa Heart Study) et finlandais (The Cardiovascular Risk in Young Finns Study) montraient que l’indice de masse corporelle (IMC) de l’enfant était positivement corrélé à l’épaisseur de l’intima-média carotidienne chez l’adulte, indépendamment de l’IMC et des facteurs de risque vasculaire présents à cet âge (44, 45).
C. Le risque cardiovasculaire est lié seulement à la persistance de l’obésité à l’âge adulte :
Un premier travail portant sur le suivi de 3 cohortes britanniques n’a pas retrouvé d’association entre l’IMC durant l’enfance ou l’adolescence et le risque vasculaire à l’âge adulte lorsque les facteurs de confusion, dont, notamment, la persistance de l’obésité à l’âge adulte, étaient pris en compte (46). D’autres études aboutissant à la même conclusion ont suivi et ont été regroupées dans une méta-analyse de 16 travaux qui conclut que l’obésité durant l’enfance n’est pas un facteur de risque indépendant de maladies cardiovasculaires ultérieures, le lien entre ces 2 pathologies étant attribué à la seule persistance de la surcharge pondérale de l’enfance à l’âge adulte (47).Cependant , bien que les résultats de cette revue systématique aient semblé clore le débat, un doute persistait pour certains. Une très belle étude portant sur le suivi prospectif de l’enfance à l’âge adulte de 4 cohortes de patients a finalement définitivement confirmé que seule la persistance de l’obésité à l’âge adulte était associée à un risque vasculaire accru (48). Dans ce travail, la probabilité d’avoir des facteurs de risque vasculaire (diabète, HTA, augmentation du LDL-cholestérol ou de la triglycéridémie, diminution du HDL-cholestérol, épaisseur de l’intima-média carotidienne) était identique chez les individus n’ayant jamais été obèses et chez ceux qui avaient été obèses durant l’enfance et devenaient normo pondéraux à l’âge adulte, mais elle était augmentée chez les adultes obèses depuis l’enfance et chez ceux devenus obèses à l’âge adulte alors qu’ils étaient normo pondéraux durant l’enfance. Ces résultats ne sont pas surprenants, car les anomalies de la fonction artérielle présentes chez l’enfant obèse ne s’installent pas définitivement, mais sont au contraire rapidement réversibles. En effet, la perte pondérale (49) ou l’activité physique (50) entraînent une amélioration rapide de l’épaisseur de l’intima-média carotidienne chez l’enfant obèse, démontrant ainsi le caractère hautement réversible de ces altérations artérielles. Enfin, l’absence d’association entre des gènes de prédisposition aux pathologies cardiovasculaires chez l’adulte (variants situés dans des gènes impliqués dans le système rénine-angiotensine [enzyme de conversion, angiotensinogène, récepteur de type 1 de l’angiotensine], le remodelage vasculaire [stromélysine 1, inhibiteur de type 1 de l’activateur du plasminogène], les jonctions entre cellules endothéliales [connexine 37], l’adhérence leucocytaire et l’inflammation endothéliale [récepteur de la fractalkine], la vasodilatation artérielle [oxyde nitrique synthase], la sécrétion d’adiponectine et le métabolisme des lipoprotéines [paraoxonase 1] et les anomalies de la fonction artérielle chez l’enfant obèse (51), étaye l’hypothèse selon laquelle l’obésité de l’enfant n’a pas d’influence directe sur le risque cardiovasculaire à l’âge adulte
Conclusion
La progression croissante de la prévalence de l’obésité infantile suscite de vives inquiétudes, car elle fait craindre une recrudescence de pathologies cardiovasculaires au cours des prochaines décennies. Il est donc indispensable de dépister le syndrome métabolique précocement chez l’enfant et l’adolescent afin de mettre en œuvre des moyens thérapeutiques efficaces qui permettraient la réversibilité des lésions.
Référence
1. Définition de l’obésité et Prévalence de l’obésité et du surpoids dans le monde-OMS 2020. Lien : https://www.who.int/fr/news-room/fact-sheets/detail/obesity-and-overweight
2.Earl S. Ford, Md, Mph, And Chaoyang Li, Md, Ph ; Defining the Metabolic Syndrome in Children and Adolescents: Will the Real Definition Please Stand Up? J Pediatr 2008;152:160-4
3.Cook S, Weitzman M, Auinger P, Nguyen M, Dietz Wh. Prevalence of a metabolic syndrome phenotype in adolescents: findings from the third National Health and Nutrition Examination Survey, 1988-1994. Arch Pediatr Adolesc Med 2003; 157, 821-827
4.De Ferranti Sd, Gauvreau K, Ludwig Ds, Newfeld Ej, Newburger Jw, Rifai N. Prevalence of the metabolic syndrome in American adolescents: findings from the third national health and nutrition examination survey. Circulation 2004; 110: 2494–2497.
5.Cruz Ml,Weigensberg Mj,Huang Tt,Ball G,Shaibi Gq,Goran ;The metabolic syndrome in overweight Hispanic youth and the role of insulin sensitivity. J Clin Endocrinol Metab 2004; 89, 108-113.
6.Weiss R, Dziura J, Burgert Ts, Tamborlane Wv, Taksali Se, Yeckel Cw, Et Al. Obesity and the metabolic syndrome in children and adolescents. N Engl J Med 2004; 350, 2362-2374.
7.Ford Es, Ajani Ua, Mokdad Ah. The metabolic syndrome and concentrations of C-reactive protein among U.S. youth. Diabetes Care 2005; 28, 878-881.
8.Joliffe Cj, Janssen I. Development of age-specific metabolic syndrome criteria that are linked to the Adult Treatment Panel III and International Diabetes Federation Criteria. J Am Coll Cardiol 2007; 49: 891-8.
9.Zimmet P, Alberti Kgmm, Kaufman F, Tajima N, Silink M, Arslanian S, Wong G, Bennett P, Shaw J, Caprio S; IDF Consensus Group. The metabolic syndrome in children and adolescents – an IDF consensus report. Pediatric Diabetes 2007 Oct; 8(5): 299-306.
10.Lee S, Bacha F, Gungor N, Arslanian Sa Waist circumference is an independant predictor of insulin resistance in Black and white youths. J Pediatr 2006 ; 148 (2) : 188-94
11.Moreno La, Pineda I, Rodri’guez G, Fleta J, Sarria A, Bueno M Waist circumference for the screening of the metabolic syndrome in Children. Acta Pediatr 2002 ;91(12):1307-12
12.Giordano, P., Del Vecchio, G.C., Cecinati, V., Delvecchio, M., Altomare, M., De Palma, F., De Mattia, D., Cavallo, L., and Faienza, M.F. (2011). Metabolic, inflammatory, endothelial andhaemostatic markers in a group of Italian obese children and adolescents. Eur. J. Pediatr. 170, 845–850.
13.Chen, L., Chen, R., Wang, H., and Liang, F. (2015). Mechanisms Linking Inflammation to Insulin Resistance. Int. J. Endocrinol. 2015.
14.Maury, E., Noël, L., Detry, R., and Brichard, S.M. (2009). In Vitro Hyperresponsiveness to Tumor Necrosis Factor-α Contributes to Adipokine Dysregulation in Omental Adipocytes of Obese Subjects. Mol. Endocrinol. 23, 422.
15.Aatola, H., et all. (2017). The Cardiovascular Risk in Young Finns Study. Hypertens. Dallas Tex 1979 70, 531–536.
16.Isabelle Aeberli, et all: Serum Retinol-Binding Protein 4 Concentration and Its Ratio to Serum Retinol Are Associated with Obesity and Metabolic Syndrome Components in Children J Clin Endocrinol Metab 2007; 92: 4359–4365
17.Bastard, J.-P., Maachi, M., Lagathu, C., Kim, M.J., Caron, M., Vidal, H., Capeau, J., and Feve, B. (2006). Recent advances in the relationship between obesity, inflammation, and insulin resistance. Eur. Cytokine Netw. 17, 4–12.
18.Simmonds M, Llewellyn A, Owen CG, Woolacott N. Predicting adult obesity from childhood obesity: a systematic review and meta-analysis. Obes Rev 2016;17(2):95-107.
19.Tounian P, Aggoun Y, Dubern B et al. Presence of increased stiffness of the common carotid artery and endothelial dysfunction in severely obese children: a prospective study. Lancet 2001;358(9291):1400-4.
20.Mimoun E, Aggoun Y, Pousset M et al. Association of arterial stiffness and endothelial dysfunction with metabolic syndrome in obese children. J Pediatr 2008;153(1):65- 70.
21.Thomas Reinehr , Rainer Wunsch , Gideon De Sousa , Andr´E Michael Toschke Relationship between metabolic syndrome definitions for children and adolescents and intima-media thickness Atherosclerosis 2008;199 : 193–200
22.Veronique Beauloye, Francis Zech, Hiep Tran Thi Mong, Philippe Clapuyt, Marc Maes, And Sonia M. Brichard Determinants of Early Atherosclerosis in Obese Children and Adolescents J Clin Endocrinol Metab 2007; 92: 3025–3032
23.Juonala M, Jarvisalo Mj, Maki-Torkko N, Kahonen M, Viikari Js, Raitakari Ot Risk factors identified in childhood and decreased carotid artery elasticity in adulthood: the cardiovascular risk in young finns study. Circulation 2005; 112(10):1486-93
24.Shanthi Sivanandam, Mda, Alan R. Sinaiko, Mda, David R. Jacobs, Jr., Phdb, Lyn Steffen, Phdb,Antoinette Moran, Mda, And Julia Steinberger, Md, Ms , Relation of Increase in Adiposity to Increase in Left Ventricular Mass from Childhood to Young Adulthood Am J Cardiol 2006; 98: 411– 415
25.Kwiterovich Jr., P.O. Young Adults with Hypercholesterolemia. Amer. J. of Med 1999. 107, (2A) Sup.40-42.
26.Kwiterovich Jr., P.O., Barton B.A., Mcmahon R.P., And Al. Effects of Diet and Sexual Maturation on Low-Density Lipoprotein Cholesterol during Puberty. The Dietary Intervention Study in Children (DISC). Circulation 1997 Oct 21, 96, 8, 2526-2533.
27.Liacouras C.A, And Shamir R.- Pediatric Cholesterol Screening : Missing Opportunities. J Med Sci 1997 Oct , 33, 10, 659-662.
28.Mcgill H. C., And Mcmahan C. A. Starting Earlier to Prevent Heart Disease. JAMA 2003 Nov 5; 290, 17, 2320-2324
29.Berenson Gs, Srinivasan Sr, and Al, Association between multiple cardiovascular risk factors and atherosclerosis in children and young adults.The Bogalusa Heart Study. N Engl J Med 1998; 338(23):1650-6
30.Mahoney Lt, Burns Tl,et al, Coronary risk factors measured in childhood and young adult life are associated with coronary artery calcification in young adults: the Muscatine Study. J Am Coll Cardiol 1996; 27 (2): 277-84
31.Mc Mahan Ca,Gidding Ss, et al, Pathobiological determinants of atherosclerosis in youth risk scores are associated with early and advanced atherosclerosis. Pediatrics 2006 ; 118(4) : 1447-55
32.Raitakari Ot,Juonala M, Et Al Cardiovascular risk factors in childhood and carotid artery intima-media thickness in adulthood: the cardiovascular risk in young finns study. JAMA 2003 ; 290 (17):2277-83
33.Oren A,Vos Le, Uiterwaal Cs , Et Al The Athersclerosis Risk in Young Adults (ARYA) study: rationale and design Eur J Epidemiol 2003; 18 (7) :715-27
34.Carrie Armstrong Cardiovascular Risk Reduction in Children Circulation, December 12, 2006 Volume 114, Issue 24
35.Emmanuelle Mimoun, Md, Yacine Aggoun, And Al Association of Arterial Stiffness and Endothelial Dysfunction with Metabolic Syndrome in Obese Children J Pediatr 2008;153:6570
36.Mieczysław Litwin, Joanna S´ Ladowska, et Al , Metabolic Abnormalities, Insulin Resistance, and Metabolic Syndrome in Children With Primary Hypertension AJH 2007; 20:875–882
37.Gregory B. Luma, M.D., And Roseann T. Spiotta, M.D Hypertension in Children and Adolescents Am Fam Physician 2006;73:1158-68
38.Cote, A. T., Harris, et Al, Childhood obesity and cardiovascular dysfunction. J. Am. Coll. Cardiol. 62, 1309–1319 (2013).
39.Rodicio, M. M. et al. Early cardiac abnormalities in obese children and their relationship with adiposity. Nutrition 46, 83–89 (2018).
40.Marcovecchio, M. L. et al. Increased left atrial size in obese children and its association with insulin resistance: A pilot study. Eur. J. Pediatr. 175, 121–130 (2016)
41.Burden et al, The effect of overweight/obesity on diastolic function in children and adolescents: A meta-analysis. Clinical Obesity. 2021;e12476.
42.Must A, Jacques PF, Dallal GE, Bajema CJ, Dietz WH. Longterm morbidity and mortality of overweight adolescents. A follow-up of the Harvard Growth Study of 1922 to 1935. N Engl J Med 1992;327(19):1350-5.
43.Twig G, Yaniv G, Levine H et al. Body-mass index in 2.3 million adolescents and cardiovascular death in adulthood. N Engl J Med 2016;374(25):2430-40.
44.Freedman DS, Patel DA, Srinivasan SR et al. The contribution of childhood obesity to adult carotid intima- media thickness: the Bogalusa Heart Study. Int J Obes 2008;32(25):749-56.
45.Magnussen CG, Koskinen J, Chen W et al. Pediatric metabolic syndrome predicts adulthood metabolic syndrome, subclinical atherosclerosis, and type 2 diabetes mellitus but is no better than body mass index alone: the Bogalusa Heart Study and the Cardiovascular Risk in Young Finns Study. Circulation 2010;122(16):1604-11.
46.Lawlor DA, Martin RM, Gunnell D et al. Association of body mass index measured in childhood, adolescence, and young adulthood with risk of ischemic heart disease and stroke: findings from 3 historical cohort studies. Am J Clin Nutr 2006;83(4):767-73.
47.Lloyd LJ, Langley-Evans SC, McMullen S. Childhood obesity and adult cardiovascular disease risk: a systematic review. Int J Obes 2010;34(1):18-28.
48.Juonala M, Magnussen CG, Berenson GS et al. Childhood adiposity, adult adiposity, and cardiovascular risk factors. N Engl J Med 2011;365(20):1876-85.
49.Wunsch R, de Sousa G, Toschke AM, Reinehr T. Intima- media thickness in obese children before and after weight loss. Pediatrics 2006;118(6):2334-40.
50.Farpour-Lambert NJ, Aggoun Y, Marchand LM, Martin XE, Herrmann FR, Beghetti M. Physical activity reduces systemic blood pressure and improves early markers of atherosclerosis in pre-pubertal obese children. J Am Coll Cardiol 2009;54(25):2396-406.
51.Tounian A, Aggoun Y, Lacorte JM et al. Influence of polymorphisms in candidate genes on early vascular alterations in obese children. Arch Cardiovasc Dis 2010;103(1):10-8.